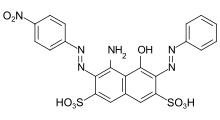
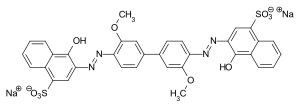
Azofarbstoff
Azofarbstoffe sind zahlenmäßig die größte Gruppe der synthetischen Farbstoffe. Charakteristisch für Azofarbstoffe sind eine oder mehrere Azobrücken (–N=N–) als Bestandteil des Chromophors. Azofarbstoffe mit mehreren Azogruppen werden als Bisazo- (auch Disazo-), Trisazo-, Tetrakisazo-, Polyazo-Farbstoffe bezeichnet. Bisazofarbstoffe, die durch Kupplung einer Diazoniumverbindung mit einer bifunktionellen Kupplungskomponente, bzw. durch Reaktion eines Bisdiazonium-Salzes mit einer Kupplungskomponente hergestellt werden, bezeichnet man als primäre Bisazofarbstoffe. Sekundäre Bisazofarbstoffe erhält man, indem man eine aminogruppenhaltige Monoazoverbindung weiterdiazotiert und kuppelt.
-
C.I. Acid Yellow 36: Monoazofarbstoff aus Metanilsäure als Diazo- und Diphenylamin als Kupplungskomponente.
-
C.I. Acid Black 1: primärer Bisazofarbstoff aus einer bifunktionellen Kupplungskomponente (H-Säure) und zwei verschiedenen Diazokomponenten (Anilin und p-Nitroanilin).
-
C.I. Direct Blue 8: primärer Bisazofarbstoff aus einem Bisdiazonium-Salz (3,3′-Dimethoxybenzidin) und Neville-Winther-Säure als Kupplungskomponente
-
C.I. Solvent Red 26: sekundärer Bisazofarbstoff. o-Toluidin wird diazotiert und auf 2,5-Xylidin gekuppelt. Der Monoazofarbstoff wird weiterdiazodiert und auf 2-Naphthol gekuppelt.
Im Gegensatz zu den Azopigmenten sind die Azofarbstoffe im jeweiligen Anwendungsmedium löslich.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Mitte des 19. Jahrhunderts hatte sich die Industrialisierung ausgehend von England auf ganz West- und Mitteleuropa ausgebreitet. Durch die Technisierung des Spinn- und Webvorgangs erhielt die Textilindustrie einen Aufschwung, der auch die Nachfrage nach Farbstoffen erhöhte. Diesen neuen Anforderungen kam die Produktion natürlich gewonnener Farbstoffe nicht nach, was die Farbforschung und die rasche Entwicklung der chemischen Industrie förderte.
1844 wagte Justus von Liebig die Prognose, man werde schon bald Methoden entdecken, um aus Steinkohlenteer Farb- und Arzneistoffe synthetisch herzustellen.
1856 schließlich gelang dem Engländer William H. Perkin beim Experimentieren mit Steinkohlenteer die Synthese des ersten künstlichen Teerfarbstoffs Mauvein, der jedoch kein Azofarbstoff ist.[1] Auf der Londoner Weltausstellung erregte er aber Aufsehen, auch dies förderte die weitere Forschung. Die Diazotierung wurde dann 1857 von Peter Grieß, einem Schüler von August Wilhelm von Hofmann gefunden.[2] Chemiker entdeckten überall in Europa Herstellungswege für eine ganze Palette solcher Teerfarbstoffe, von Hofmann-Violett über Fuchsin, von Anilingelb (1861) bis hin zu Bismarckbraun, wobei die beiden letztgenannten wichtige Vertreter der Gruppe der Azofarbstoffe sind. Ausgangsstoff war das Anilin, das aus Kohlenteer gewonnen wurde, daher wurde diese Gruppe auch Teerfarbstoffe genannt. Anilingelb ist im Colour Index als C.I. Solvent Yellow 1 gelistet, ein nicht wasser-, jedoch fettlöslicher Farbstoff. Kongorot (C.I. Direct Red 28) wurde 1884 als erster Bisazofarbstoff (auch Disazofarbstoff) hergestellt. C.I. Disperse Yellow 8 wurde 1926 als wasserunlöslicher Dispersionsfarbstoff entwickelt und wird auch heute noch zum Färben von Polyester-Stoffen genutzt.
Azofarbstoffe wurden schon frühzeitig als Lebensmittelfarbstoffe eingesetzt, beispielsweise Buttergelb (C.I. Solvent Yellow 2) zum Färben von Butter und Margarine. Die Verwendung von Buttergelb zur Margarinefärbung wurde jedoch 1938 verboten, nachdem man erkannt hatte, dass es bei Ratten Leberkarzinome erzeugen kann.[3] Darüber hinaus gab es noch um 1949 nur wenige Einschränkungen, Azofarbstoffe Nahrungsmitteln zur „Verschönerung“ zuzusetzen.[4]
Aufbau und Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Azofarbstoffe bilden zahlenmäßig die größte Farbstoffklasse. Sie sind durch die allgemeine Formel R1-N=N-R2 charakterisiert. Die beiden Reste (R1 und R2, in der Regel aromatisch) können identisch oder verschieden sein.
Typisch für Azofarbstoffe ist die Azogruppe -N=N- mit der farbgebenden (chromophoren) Stickstoff-Doppelbindung. Diese synthetischen Farbstoffe nutzen als Ausgangsstoff aromatische Amine, im einfachsten Falle das Anilin. Azofarbstoffe erreichen ihre Vielfalt durch die einfache Substitution der Wasserstoffatome an den aromatischen Ringen, die das chromophore System auxochrom beeinflussen und über die man die Farbnuance steuern kann.
Azofarbstoffe weisen oft polare und unpolare Substituenten auf und können so auf das erforderliche Medium gezielt zugeschnitten werden. Bei entsprechendem Aufbau können sie neben Van-der-Waals-Bindungen auch Wasserstoffbrückenbindungen ausbilden.
Vertreter der Gruppe sind farbstabil und ergeben lichtechte und farbstarke Färbungen. Bei geeigneter Konstitution können sie auf Textilien wasch-, reinigungs- und reibecht sein.
Bei Raumtemperatur im Dunklen ist die trans-Konfiguration stabiler aromatischer Azoverbindungen die energetisch günstigste Konformation. Unter Einwirkung von Licht oder Hitze kann sich diese Konformation zum cis-Isomer und somit seine geometrische Form verändern. Dies kann eine nützliche Eigenschaft sein, um reversible molekulare Schalter herzustellen. Durch Einführen von Fragmenten stabiler Azoverbindungen wie Azobenzol in biologisch aktive Moleküle wie Proteine kann eine Vielzahl von biologischen Prozessen räumlich und zeitlich durch Bestrahlung mit Licht anstatt Reagenzien gesteuert werden.[5][6][7]
Nomenklatur
[Bearbeiten | Quelltext bearbeiten]
In Abhängigkeit von der Anzahl der Azogruppen werden die Verbindungen als Mono-, Dis-, Tris-, Tetrakis-, etc. -Azofarbstoffe gekennzeichnet. Ab drei Azogruppen bezeichnet man sie oft einfach als Polyazofarbstoffe.
Oft wurden Azofarbstoffe in der Vergangenheit nicht nach der IUPAC-Nomenklatur benannt, da insbesondere technische Polyazofarbstoffe sehr komplexe Namen ergeben. Stattdessen wurde ein Schema verwendet, bei dem die einzelnen Komponenten durch Pfeile verbunden sind. Dabei geht der Pfeile von dem Diazoniumion-liefernden Amin aus und zeigt auf die angekuppelte Verbindung. Auf diese Weise lassen sich auch komplexere Azofarbstoffe mit mehreren Azogruppen einfach beschreiben.[8] Der Nachteil der Pfeilnomenklatur ist, dass die exakte Verknüpfungsstelle an der gekoppelten Komponente nicht angegeben wird.
Der Name Azo leitet sich vom französischen Wort Azote für Stickstoff ab, das selbst auf altgriechisch ἄζωτος ázōtos („lebensfeindlich“) zurückgeht.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Die Vielfalt der Azofarbstoffe ergibt sich aus der vergleichsweise einfachen Herstellungsweise. Durch die Diazotierung aromatischer Amine erhält man Diazoniumsalze, die mit elektronenreichen aromatische Verbindungen oder β-Dicarbonyl-Verbindungen im Sinne einer Azokupplung reagieren.
Die Synthese erfolgt in zwei Schritten:
1. Diazotierung: Die Lösung oder Suspension eines aromatischen Amins wird mit Salz- oder Schwefelsäure angesäuert und bei tiefer Temperatur mit einer Natriumnitrit-Lösung versetzt. Dabei bildet sich ein elektrophiles Nitrosyl-Kation (NO+).
Das Nitrosyl-Kation wird von dem freien Elektronenpaar des Stickstoffatoms am Arylamin angegriffen. Unter Abspaltung eines Protons (H+) entsteht eine N-Nitroso-Verbindung (Ar-NH-N=O), die sich in das instabile Aryldiazohydroxid (Ar-N=N-OH) umlagert. Dieses zerfällt unter Abspaltung eines OH−-Ions und es entsteht ein Aryldiazonium-Ion (Ar-N2+). Bei der Diazotierung sollte man immer unter 5 °C kühlen, da die Diazoniumsalze sonst Stickstoff abspalten (Zersetzungsgefahr).
2. Azokupplung: Die Azokupplung stellt eine elektrophile Zweitsubstitution dar. Die Substituenten, die einen +M-Effekt aufweisen, erhöhen die Elektronendichte und somit die Reaktivität. Zudem dirigieren sie die Zweitsubstituenten in para-Stellung. Die ortho-Stellung ist aus Gründen der sterischen Hinderung selten.
Die Herstellung von Azofarbstoffen ist ein beliebtes Thema im Chemieunterricht, dessen experimentelle Durchführung darunter leidet, dass viele Amine giftig sind und gemäß RiSU in der Schule nicht angewendet werden dürfen. Dieses Problem lässt sich durch die Anwendung ungiftiger Amine umgehen, z. B. durch Einsatz von Sulfanilsäure als Diazokomponente und der natürlichen Aminosäuren Histidin und Tyrosin als Kupplungskomponente.[9]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Diese Farbstoffgruppe ist aufgrund der vielfältigen Kupplungsmöglichkeiten mit Farbstoffen im gesamten Farbbereich vertreten. Azofarbstoffe werden zur Färbung von Textilien, Fetten und Ölen, zum Einfärben von Wachsen, Stroh, Holz, und für Papier eingesetzt. Auch für Beschichtungsstoffe, etwa bei CD-R, sind sie im Einsatz. Azofarbstoffe, die giftige oder krebserzeugende Amine freisetzen können, sind in Deutschland für Gebrauchsgegenstände und Tätowiermittel verboten. Sie dürfen weder zur Stofffärbung noch für Schmuck und keinesfalls für Kosmetikartikel angewendet werden.
Ausgewählte Azofarbstoffe sind auf ihre Eignung als Lebensmittelfarbstoffe geprüft und zugelassen. Im Übrigen besitzen solche Farbstoffe mehrere Sulfongruppen, um die Löslichkeit in Wasser zu erhöhen. Die hohe Wasserlöslichkeit statt einer Fettlöslichkeit des Farbkörpers verhindert die Gefahr der Einlagerung im Körper, indem die Stoffe leichter durch den Urin ausgeschieden werden.
-
Erdbeerbrause mit Allurarot AC
-
Allurarot AC als Farbstoff in einer Süßigkeit
Für Lederfarbstoffe kommen ebenfalls Azofarbstoffe zum Einsatz, wobei hier eher auf Fettlöslichkeit geachtet wird, aber auch hier dürfen Kopplungsprodukte mit bestimmten Aminen nicht eingesetzt werden.
Gesundheitliche Bedenken gab es unter anderem auch bei mit Azofarben gefärbten Ostereiern, welche jedoch unbestätigt blieben, da eine viel zu niedrige Dosis des Farbstoffes durch die Schale in das Ei gelangt.[10]
In der Medizin dienen ausgewählte Produkte zum Anfärben von Krebszellen. In der klinischen Chemie sind sie weiterhin wichtig, um bestimmte Stoffwechselprodukte wie Bilirubin nachzuweisen. Sie entstehen durch Komplexbildung zwischen diversen Reagenzien und dem nachzuweisenden Stoff und werden anschließend photometrisch gemessen.
Die Azobrücke liegt abhängig vom pH-Wert in protonierter oder deprotonierter Form vor. Damit ist eine Verschiebung der Farbtiefe verbunden. Azofarbstoffe werden deshalb auch als Säure-Base-Indikatoren eingesetzt. Beispiele dafür sind Methylrot, Methylorange, Kongorot und Alizaringelb R. Darüber hinaus gibt es auch Redoxindikatoren unter den Azofarbstoffen.

pH-Wert unter 4,4 wird das Molekül am Stickstoff protoniert, die polarisierte Azobrücke führt zur
Farbvertiefung nach rot durch Absorption von nun grünem (längerwelligem) Licht (rechte Struktur).
Gesundheitsgefährdung
[Bearbeiten | Quelltext bearbeiten]Es wurde bewiesen, dass der menschliche Körper in der Lage ist, durch reduktive Spaltung die aufgenommenen Azofarbstoffe an der Azobrücke wieder in die Ausgangsstoffe zu spalten. Dies kann durch Darmbakterien oder durch Azoreduktasen der Leber oder extrahepatischen Gewebes geschehen. Daher gibt es den Verdacht, dass alle Azofarbstoffe, die eine freisetzbare kanzerogene Arylaminkomponente enthalten, ein krebserzeugendes Potential haben.
Azofarbstoffe, die aus mindestens einem dieser kanzerogenen Amine aufgebaut sind, sind in Textilien und Leder in Deutschland nach der Bedarfsgegenständeverordnung (BedGgstV) verboten.[11] EU-weit sind diese nach REACH-Verordnung in Verbraucherprodukten verboten. Dieses Verbot gilt für Textilien und Leder, die mit der menschlichen Haut oder der Mundhöhle direkt und längere Zeit in Berührung kommen können. Zurzeit sind 24 aromatische Amine betroffen, von denen Benzidin am bekanntesten ist. Benzidinfarbstoffe stehen in Verdacht, bei Exposition das Blasenkrebsrisiko deutlich zu erhöhen. Nach der EU-Richtlinie dürfen Azofarbstoffe, die durch reduktive Spaltung von Azogruppen derartige Amine mit mehr als 30 ppm im Fertigerzeugnis freisetzen können, nicht verwendet und entsprechende Textil- und Ledererzeugnisse nicht in den Verkehr gebracht werden. Die analytische Bestimmungsgrenze variiert je nach Amin um 5 ppm. In der EU werden diese Farbstoffe in der Textil- und Lederindustrie seit Jahren nicht mehr eingesetzt. Da auch Importe von Gebrauchsmitteln (so Textilien aus Asien) nicht mit derartigen gesundheitsgefährdenden Farbstoffen gefärbt werden dürfen, werden von den zuständigen Behörden stichprobenartige Untersuchungen durchgeführt.
Im Gegensatz zu Azofarbstoffen sind Azopigmente im Anwendungsmedium praktisch unlöslich. Wegen der Unlöslichkeit sind Azopigmente nicht bioverfügbar und somit ungiftig und nicht krebserregend. Sie werden für Druckfarben, Kunststoffe, Lacke, Toner und Lebensmittelverpackungen eingesetzt.
Rechtliche Situation
[Bearbeiten | Quelltext bearbeiten]Die EU-Kommission beauftragte am 25. März 2010 die EFSA (European Food Safety Authority), eine neuerliche gesundheitliche Bewertung fraglicher Azofarbstoffe vorzunehmen. Seit dem 20. Juli 2010 müssen Lebensmittel, die die Azofarbstoffe Tartrazin (E 102), Gelborange S (E 110), Azorubin (E 122), Allurarot (E 129) oder Cochenillerot A (E 124) enthalten, in der Europäischen Union mit dem gesonderten Warnhinweis „Kann Aktivität und Aufmerksamkeit bei Kindern beeinträchtigen“ gekennzeichnet werden.[12][13][14]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Agnes Slowicki, Heiko U. Käfferlein, Thomas Brüning: Hautgängigkeit von Azofarbmitteln. Teil 1: Eigenschaften, Aufnahme über die Haut und Metabolismus. Gefahrstoffe – Reinhaltung der Luft 69(6), S. 263–268 (2009).
- H. Zollinger: Chemie der Azofarbstoffe. In: Birkhäuser (Hrsg.): Lehrbücher und Monographien aus dem Gebiete der Exakten Wissenschaften. Springer Verlag, Basel 1958, ISBN 978-3-7643-0425-6, doi:10.1007/978-3-0348-6838-9 (308 S.).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Richtlinie 2002/61/EG
- Genauere Informationen zu den „klappenden Elektronenpaaren“ während der Azokupplung
- Weiterführende Information zum Diazotierungsmechanismus
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Rudolf Winderlich: Lehrbuch der Chemie für Höhere Lehranstalten: Einheitsausgabe für Unter- und Oberstufe. Springer-Verlag, 2013, ISBN 978-3-663-04370-6, S. 391 (books.google.de).
- ↑ Heinz-Gerhard Franck, Jürgen W. Stadelhofer: Industrielle Aromatenchemie: Rohstoffe · Verfahren · Produkte. Springer-Verlag, 2013, ISBN 978-3-662-07875-4, S. 6 (books.google.de).
- ↑ Werner Baltes: Lebensmittelchemie. 5. Auflage. Springer Verlag, Berlin, Heidelberg 2000, ISBN 978-3-662-08282-9, S. 187 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ernst Kern: Sehen – Denken – Handeln eines Chirurgen im 20. Jahrhundert. ecomed, Landsberg am Lech 2000, ISBN 3-609-20149-5, S. 198.
- ↑ Estíbaliz Merino, María Ribagorda: Control over molecular motion using the – photoisomerization of the azo group. In: Beilstein Journal of Organic Chemistry. Band 8, 2012, S. 1071–1090, doi:10.3762/bjoc.8.119.
- ↑ Ned A. Porter, Lawrence J. Marnett: Photolysis of unsymmetric azo compounds. cis Azo compound intermediates. In: Journal of the American Chemical Society. Band 95, Nr. 13, 27. Juni 1973, S. 4361–4367, doi:10.1021/ja00794a036.
- ↑ Michael B. Smith, Jerry March: March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. John Wiley & Sons, 2007, ISBN 978-0-470-08494-6, S. 346 (books.google.de).
- ↑ H. Zollinger: Chemie der Azofarbstoffe. In: Birkhäuser (Hrsg.): Lehrbücher und Monographien aus dem Gebiete der Exakten Wissenschaften. Springer Verlag, Basel 1958, ISBN 978-3-7643-0425-6, S. 177–178, doi:10.1007/978-3-0348-6838-9 (308 S.).
- ↑ Klaus Ruppersberg et al.: Azofarbstoffe ohne giftige Amine und ohne Eiskühlung. In: CHEMKON. Band 25, Nr. 3. VCH Chemie, Weinheim Juni 2018, S. 121–122, doi:10.1002/ckon.201880371.
- ↑ Ostereierfarben – Krebs auf Raten? 8. April 2012, Jochen Kleboth, lebensmittelfokus.at Lebensmittelfokus ( vom 11. Dezember 2013 im Internet Archive)
- ↑ Bedarfsgegenständeverordnung, Anlage 1 (zu § 3). Stoffe, die bei dem Herstellen oder Behandeln von bestimmten Bedarfsgegenständen nicht verwendet werden dürfen. Bundesministerium der Justiz und für Verbraucherschutz, abgerufen am 29. Oktober 2019.
- ↑ Verordnung (EG) Nr. 1333/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über Lebensmittelzusatzstoffe. (PDF).
- ↑ Reinhard Wolff: Knallbunt ist ungesund. Beitrag in die tageszeitung vom 19. Juli 2010, S. 9.
- ↑ Foodwatch: Warnhinweis für Azofarbstoffe. Pressemitteilung vom 20. Juli 2010.