Chemie der Kohlenstoffnanoröhren
Die Chemie der Kohlenstoffnanoröhren (englisch carbon nanotube chemistry) handelt von chemischen Reaktionen, die angewandt werden, um die Eigenschaften von Kohlenstoffnanoröhren (Carbon nanotubes, CNTs) zu verändern. Dabei können die CNTs derart funktionalisiert werden, dass sie die gewünschten Eigenschaften für verschiedene Anwendungen haben.

Zwei bedeutende Methoden sind die Funktionalisierung der kovalenten und der nicht-kovalenten Bindungen.[1]
Wegen ihrer hydrophoben Eigenschaften tendieren CNTs zur Agglomeration, was die Dispersion in Lösungsmitteln oder in viskosen Polymerschmelzen verhindert. Die resultierenden Nanoröhrenbündel oder -knäuel verschlechtern die Verwendbarkeit des endgültigen Werkstoffes. Die Oberfläche der CNTs kann nun so variiert werden, dass sie weniger hydrophob sind und dass durch Anknüpfen funktioneller Gruppen die Oberflächenhaftung an ein Polymer verbessert wird.
Toxizität der funktionalisierten CNTs
[Bearbeiten | Quelltext bearbeiten]In vitro Studien zeigen, dass funktionalisierte Kohlenstoffnanoröhren ein zytotoxisches Potenzial für menschliche Epithelzellen und die Makrophagen der Maus aufweisen.[2]
Kovalente Modifizierung
[Bearbeiten | Quelltext bearbeiten]Bei der kovalenten Modifizierung werden die Nanoröhren mit funktionellen Gruppen versehen. Diese können entweder an die Seitenwand oder an das Ende einer Nanoröhre angeknüpft werden.[1]
Die höchste chemische Reaktivität besitzen bei verschlossenen Nanoröhren die Semifulleren-artigen Kappen. Die Semifullerenstruktur enthält Fünfringe und ist daher reaktiver als die glatte, hexagonale Seitenwand.[3]
Durch die kovalente Funktionalisierung der Nanoröhren werden durch die Bildung neuer σ-Bindungen die Zahl der sp2-hybridisierten C-Atome verringert. Die Unterbrechung des delokalisierten π-Elektronen-Systems vermindert typischerweise die Leitfähigkeit der Kohlenstoffnanoröhre.
Oxidation
[Bearbeiten | Quelltext bearbeiten]Die Reinigung und Oxidation der CNTs wurde oft in der Literatur erwähnt.[4][5][6][7] Diese Prozesse waren wichtig für eine Darstellung von Kohlenstoffnanoröhren mit geringer Ausbeute, wo Kohlenstoffpartikel und amorpher Kohlenstoff einen signifikanten Anteil am Material ausmachen und immer noch wichtig sind bei der Anknüpfung funktioneller Gruppen an die Oberfläche.[8] Während der Oxidation wird das Kohlenstoff-Kohlenstoff-Bindungs-Netzwerk der Graphitschichten aufgebrochen, indem es die Einführung von Sauerstoffeinheiten erlaubt, und so Carboxyl-, Phenol- und Lactongruppen bildet,[9] die ausreichend erforscht worden sind für weitere chemische Funktionalisierungen.[10]
Erste Untersuchungen an Oxidationen von Nanoröhren verwendeten eine Gasphasen-Reaktion mit Salpetersäuredampf, wodurch die Nanoröhren unselektiv mit Carboxyl-, Carbonyl- und Hydroxygruppen funktionalisiert wurden.[11] In Flüssigphasenreaktionen wurden Nanoröhren mit den oxidierenden Lösungen Salpetersäure oder Königswasser mit dem gleichen Effekt behandelt.[12] Jedoch kann bei "Überoxidation" das Nanorohr auseinanderbrechen in Fragmente, bekannt als Kohlenfragmente.[13] Xing et al. untersuchten ultraschallunterstützte Oxidation von CNTs mit Schwefel- und Salpetersäure und produzierten Carbonyl- und Carboxygruppen.[14] Wird die Oxidation mit Säure durch Behandlung mit Wasserstoffperoxid abgestoppt, verhindert man die Zerstörung des CNTs.[15] Einwandige Nanoröhren können mit Oleum (100% H2SO4 with 3% SO3) und Salpetersäure verkürzt werden.[1]
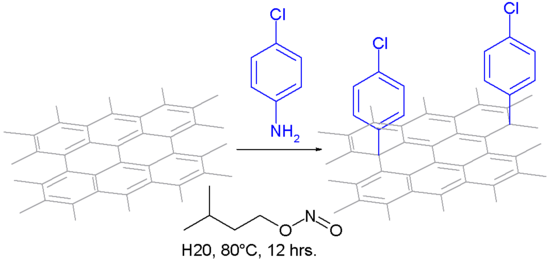
Bei einem Reaktionstyp wird es mit Anilin zum Diazoniumsalz oxidiert und mit Stickstoff durchspült, so dass eine kovalente Bindung entsteht, bei der ein Arylradikal gebildet wird.[16] Das Oxidationsreagenz ist Isoamylnitrit in einer wässrigen Suspension.
Veresterung/Amidbildung
[Bearbeiten | Quelltext bearbeiten]Carbonsäuren sind der Vorläufer für Veresterungen und Amidbildungen. Die Carboxygruppe wird zunächst mit Thionylchlorid oder mit Oxalylchlorid zum Säurechlorid umgewandelt, das dann zum Amid, Amin oder zum Alkohol umgesetzt wird.[17] CNTs können mit Hilfe von Aminierungsreaktionen mit Silbernanopatikeln beschichtet werden. Es wurden amidfunktionalisierte CNTs als Chelate für Silbernanopartikel dargestellt. Mit Acylchlorid modifizierte CNTs reagieren mit verzweigten Molekülen wie Polyamidoamin, das als Templat für Silberionen einsetzbar ist und später mit Formamid reduziert wird.[18] Amino-modifizierte CNTs können durch die Reaktion eines acylchloridmodifizierten CNTs mit Ethylendiamin dargestellt werden.[19]
Cycloaddition
[Bearbeiten | Quelltext bearbeiten]Es sind Cycloadditionen wie Diels-Alder-Reaktionen oder 1,3-dipolare Cycloadditionen mit Azomethin-yliden bekannt, ebenso wie Azid-Alkin-Cycloadditionen.[20] Ein Beispiel ist eine Diels-Alder-Reaktion mit Chromhexacarbonyl unter hohem Druck.[21] Das ID/IG Isomerenverhältnis bei der Reaktion mit Danishefsky’s Dien ist 2.6.
Die bekannteste 1,3-Cycloaddition ist die Reaktion eines CNTs mit einem Azomethinylid. Die Addition von Pyrrolidin kann zu einer Reihe funktioneller Gruppen führen, wie Polyamidoamin-Dendrimeren,[22] Phthalocyaninen,[23] Perfluoroalkylsilanen,[24] und Aminoethyleneglycol-Gruppen.[25] Die Diels-Alder-Cycloaddition läuft vor allem bei fluorierten CNTs ab. Edukte für Diels-Alder-Reaktionen sind bekanntlich Diene wie 2,3-Dimethyl-1,3-Butadiene, Anthracene, and 2-Trimethylsiloxyl-1,3-Butadiene.[19]
Radikalische Addition
[Bearbeiten | Quelltext bearbeiten]
Die Modifikation von CNTs mit Aryldiazoniumsalzen wurde zuerst von Tour et al. untersucht.[27] Wegen der extremen Reaktionsbedingungen für die in-situ-Erzeugung des Diazoniumions wurde nach anderen Methoden gesucht. Stephenson et al. berichten über eine Reaktion von Anilinderivaten mit Natriumnitrid in 96%iger Schwefelsäure und Ammoniumpersulfat.[28] Price et al. führten die Reaktion unter milderen Reaktionsbedingungen durch, indem sie CNTs in Wasser rührten und mit Anilin und mildem Oxidationsmittel behandelten.[1] Die Diazoniumchemie wurde verwendet, um weitere Modifizierungen an CNTs vorzunehmen, wie z. B. mit der Suzuki-Reaktion und der Heck-Reaktion. Kupplungsreaktionen wurden durchgeführt mit iodophenyl-funktionalisierten CNTs.[29] Wong et al. zeigten Silylierungsreaktionen mit Trimethoxysilan und mit Heptaphenyldisilan unter milden photochemischen Reaktionsbedingungen.[30]
Nucleophile Addition
[Bearbeiten | Quelltext bearbeiten]Hirsch et al. führten nucleophile Additionen mit Organolithiumreagenzien und mit Organomagnesiumverbindungen an CNTs durch. Nach darauffolgender Luftoxidation konnten sie alkylmodifizierte CNTs erzeugen.[31] Hirsch war in der Lage eine nucleophile Addition mit Aminen zu zeigen, indem er Lithiumamide erzeugte, die zu amino-modifizierten CNTs führten.[32]
Elektrophile Addition
[Bearbeiten | Quelltext bearbeiten]Nanoröhren können auch mit Alkylhalogeniden alkyliert werden, indem man Lithium oder Natrium und flüssigen Ammoniak verwendet, wie bei einer Birch-Reduktion.[33][34] Nanoröhren-Salze können als Polymerisationsinitiator wirken[35] und können mit Peroxiden unter Bildung von alkoxyfunktionalisierten Nanoröhren reagieren.[36]
Alkyl- und Hydroxy-Modifizierung von CNTs wurden durch elektrophile Addition von Alkylhaliden unter Mikrowellenbestrahlung durchgeführt.[1] Tessonier et al. modifizierten CNTs durch Deprotonierung mit Butyllithium und anschließender Amino-Substitution.[32] Balaban et al. führten Friedel-Crafts-Alkylierungen mit Nitrobenzol bei 180 °C mit Aluminiumchlorid an CNTs durch.[37]
Nicht-kovalente Modifizierungen
[Bearbeiten | Quelltext bearbeiten]
Nicht-kovalente Modifikationen nutzen van der Waals-Kräfte und π-π-Wechselwirkungen durch Adsorption von polykondensierten Aromaten, Tensiden, Polymeren und Biomolekülen. Nicht-kovalente Modifikationen zerstören nicht die Konfiguration des CNTs zu Lasten der chemischen Stabilität und sind vorteilhaft für Phasentrennungen und Dissoziationen von Feststoffen zwischen zwei Phasen.[1]
Kondensierte aromatische Verbindungen
[Bearbeiten | Quelltext bearbeiten]Kondensierte Aromaten, die hydrophile und hydrophobe Einheiten besitzen, werden verwendet, um CNTs in organischen oder wässrigen Lösungen zu lösen. Einige dieser Amphiphile sind Phenyl-, Naphthyl-, Phenanthryl-, Pyren- und Porphyrin-Systeme[38] Je größer die π-π-Wechselwirkung der aromatischen Amphiphile, desto besser die Löslichkeit.[38] Diese aromatischen Systeme können variiert werden mit Amino- und Carboxyl-Gruppen, um die CNTs zu funktionalisieren.[39]
Biomoleküle
[Bearbeiten | Quelltext bearbeiten]Ausführlich untersucht sind die Wechselwirkungen zwischen CNTs und Biomolekülen wegen ihres Potentials für biologische Anwendungen.[40] Modifizierungen von CNTs sind mit Proteinen, Kohlenhydraten und Nucleinsäuren mit der bottom-up-Technik dargestellt worden.[1] Proteine haben eine hohe Affinität zu CNTs, da die Aminosäuren, aus denen sie bestehen, sowohl hydophil als auch hydrophob sein können.[1] Polysaccharide sind erfolgreich verwendet worden, um CNTs zu modifizieren und dabei stabile Hybride zu bilden.[41] Um CNTS wasserlöslich zu machen, wurden Phospholipide, wie lysoglycerophosopholipide verwendet.[42]
π-π-Wechselwirkung und elektrostatische Wechselwirkungen
[Bearbeiten | Quelltext bearbeiten]Bifunktionelle Moleküle werden verwendet, um CNTs zu modifizieren. Ein Molekülende ist eine polyaromatische Komponente, die mit der Nanoröhre π-π-Wechselwirkungen eingeht. Das andere Ende desselben Moleküls hat eine funktionelle Gruppe wie Amino-, Carboxy- oder Thiol-Gruppen.[1] Zum Beispiel Pyren-Derivate und Arylthiole wurden als Trägermaterial für verschiedene Metall-Nanoperlen wie Gold, Silber und Platin verwendet.[43]
Charakterisierung
[Bearbeiten | Quelltext bearbeiten]Eine nützliche Analysenmethode für CNTs ist Ramanspektroskopie. Es zeigt sich ein G-Band bei 1580 cm−1 und ein D-Band bei 1350 cm−1. Das Verhältnis der beiden Peaks gibt das Maß an Funktionalisierung an.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Klaus Müllen, Xinliang Feng (Hrsg.): Chemistry of Carbon-Nanostructures, De Gruyter 2017
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Nikolaos Karousis, Nikos Tagmatarchis, Dimitrios Tasis: Current Progress on the Chemical Modification of Carbon Nanotubes. In: Chemical Reviews. Band 110, Nr. 9, 2010, S. 5366–5397, doi:10.1021/cr100018g, PMID 20545303.
- ↑ Prem Kumarathasan, Dalibor Breznan, Dharani Das, Mohamed A. Salam, Yunus Siddiqui, Christine MacKinnon-Roy, Jingwen Guan, Nimal de Silva, Benoit Simard, Renaud Vincent: Cytotoxicity of carbon nanotube variants: A comparative in vitro exposure study with A549 epithelial and J774 macrophage cells. In: Nanotoxicology. Band 9, Nr. 2, 2015, S. 148–161, doi:10.3109/17435390.2014.902519, PMID 24713075.
- ↑ Richard E. Smalley: Das Entdecken der Fullerene (Nobel-Vortrag). In: Angewandte Chemie. Band 109, Nr. 15, 1997, S. 1666–1673, doi:10.1002/ange.19971091506.
- ↑ S. C. Tsang, P. J. F. Harris, M. L. H. Green: Thinning and opening of carbon nanotubes by oxidation using carbon dioxide. In: Nature. 362. Jahrgang, Nr. 6420, 1993, S. 520–522, doi:10.1038/362520a0.
- ↑ P. M. Ajayan, T. W. Ebbesen, T. Ichihashi, S. Iijima, K. Tanigaki, H. Hiura: Opening carbon nanotubes with oxygen and implications for filling. In: Nature. 362. Jahrgang, Nr. 6420, 1993, S. 522–525, doi:10.1038/362522a0.
- ↑ S. C. Tsang, Y. K. Chen, P. J. F. Harris, M. L. H. Green: A simple chemical method of opening and filling carbon nanotubes. In: Nature. 372. Jahrgang, Nr. 6502, 1994, S. 159–162, doi:10.1038/372159a0.
- ↑ Hidefumi Hiura, Thomas W. Ebbesen, Katsumi Tanigaki: Opening and purification of carbon nanotubes in high yields. In: Advanced Materials. 7. Jahrgang, Nr. 3, 1995, S. 275–276, doi:10.1002/adma.19950070304.
- ↑ K Esumi, M. Ishigami, A. Nakajima, K. Sawada, H. Honda: Chemical treatment of carbon nanotubes. In: Carbon. 34. Jahrgang, Nr. 2, 1996, S. 279–281, doi:10.1016/0008-6223(96)83349-5.
- ↑ M Shaffer, X. Fan, A.H. Windle: Dispersion and packing of carbon nanotubes. In: Carbon. 36. Jahrgang, Nr. 11, 1998, S. 1603–1612, doi:10.1016/S0008-6223(98)00130-4.
- ↑ Ya-Ping Sun, Kefu Fu, Yi Lin, Weijie Huang: Functionalized Carbon Nanotubes: Properties and Applications. In: Accounts of Chemical Research. 35. Jahrgang, Nr. 12, 2002, S. 1096–104, doi:10.1021/ar010160v, PMID 12484798.
- ↑ Wei Xia, Chen Jin, Shankhamala Kundu, Martin Muhler: A highly efficient gas-phase route for the oxygen functionalization of carbon nanotubes based on nitric acid vapor. In: Carbon. 47. Jahrgang, Nr. 3, 1. März 2009, S. 919–922, doi:10.1016/j.carbon.2008.12.026.
- ↑ V. Datsyuk, M. Kalyva, K. Papagelis, J. Parthenios, D. Tasis, A. Siokou, I. Kallitsis, C. Galiotis: Chemical oxidation of multiwalled carbon nanotubes. In: Carbon. 46. Jahrgang, Nr. 6, 1. Mai 2008, S. 833–840, doi:10.1016/j.carbon.2008.02.012.
- ↑ Céline Bergeret, Jack Cousseau, Vincent Fernandez, Jean-Yves Mevellec, Serge Lefrant: Spectroscopic Evidence of Carbon Nanotubes’ Metallic Character Loss Induced by Covalent Functionalization via Nitric Acid Purification. In: The Journal of Physical Chemistry C. 112. Jahrgang, Nr. 42, 23. Oktober 2008, S. 16411–16416, doi:10.1021/jp806602t.
- ↑ Yangchuan Xing, Liang Li, Charles C. Chusuei, Robert V. Hull: Sonochemical Oxidation of Multiwalled Carbon Nanotubes. In: Langmuir. 21. Jahrgang, Nr. 9, 1. April 2005, S. 4185–4190, doi:10.1021/la047268e.
- ↑ F. Avilés, J. V. Cauich-Rodríguez, L. Moo-Tah, A. May-Pat, R. Vargas-Coronado: Evaluation of mild acid oxidation treatments for MWCNT functionalization. In: Carbon. 47. Jahrgang, Nr. 13, 1. November 2009, S. 2970–2975, doi:10.1016/j.carbon.2009.06.044.
- ↑ B. K. Price, J. M. Tour: Functionalization of Single-Walled Carbon Nanotubes "On Water". In: Journal of the American Chemical Society. 128. Jahrgang, Nr. 39, 2006, S. 12899–12904, doi:10.1021/ja063609u, PMID 17002385.
- ↑ Nikolaos Karousis, Nikos Tagmatarchis, Dimitrios Tasis: Current Progress on the Chemical Modification of Carbon Nanotubes. In: Chemical Reviews. 110. Jahrgang, Nr. 9, 14. Juni 2010, S. 5366–5397, doi:10.1021/cr100018g, PMID 20545303.
- ↑ Lei Tao, Gaojian Chen, Giuseppe Mantovani, Steve York, David M. Haddleton: Modification of multi-wall carbon nanotube surfaces with poly(amidoamine) dendrons. In: Synthesis and metal templating. Nr. 47, S. 4949, doi:10.1039/B609065F.
- ↑ a b J. S. Jeong, S. Y. Jeon, T. Y. Lee, J. H. Park, J. H. Shin, P. S. Alegaonkar, A. S. Berdinsky, J. B. Yoo: Fabrication of MWNTs/nylon conductive composite nanofibers by electrospinning. In: Diamond and Related Materials. 15. Jahrgang, Nr. 11–12, 1. November 2006, Proceedings of the joint 11th International Conference on New Diamond Science and Technology and the 9th Applied Diamond Conference 2006, S. 1839–1843, doi:10.1016/j.diamond.2006.08.026.
- ↑ I. Kumar, S. Rana, J. W. Cho: Cycloaddition Reactions: A Controlled Approach for Carbon Nanotube Functionalization. In: Chemistry: A European Journal. 17. Jahrgang, Nr. 40, 2011, S. 11092–11101, doi:10.1002/chem.201101260.
- ↑ C. C. Ménard-Moyon, F. O. Dumas, E. Doris, C. Mioskowski: Functionalization of Single-Wall Carbon Nanotubes by Tandem High-Pressure/Cr(CO)6 Activation of Diels-Alder Cycloaddition. In: Journal of the American Chemical Society. 128. Jahrgang, Nr. 46, 2006, S. 14764–14765, doi:10.1021/ja065698g, PMID 17105260.
- ↑ Stéphane Campidelli, Chloé Sooambar, Enrique Lozano Diz, Christian Ehli, Dirk M. Guldi, Maurizio Prato: Dendrimer-Functionalized Single-Wall Carbon Nanotubes: Synthesis, Characterization, and Photoinduced Electron Transfer. In: Journal of the American Chemical Society. 128. Jahrgang, Nr. 38, 1. September 2006, S. 12544–12552, doi:10.1021/ja063697i, PMID 16984205.
- ↑ Beatriz Ballesteros, Gema de la Torre, Christian Ehli, G. M. Aminur Rahman, F. Agulló-Rueda, Dirk M. Guldi, Tomás Torres: Single-Wall Carbon Nanotubes Bearing Covalently Linked Phthalocyanines – Photoinduced Electron Transfer. In: Journal of the American Chemical Society. 129. Jahrgang, Nr. 16, 1. April 2007, S. 5061–5068, doi:10.1021/ja068240n, PMID 17397152.
- ↑ Vasilios Georgakilas, Athanasios B. Bourlinos, Radek Zboril, Christos Trapalis: Synthesis, Characterization and Aspects of Superhydrophobic Functionalized Carbon Nanotubes. In: Chemistry of Materials. 20. Jahrgang, Nr. 9, 1. Mai 2008, S. 2884–2886, doi:10.1021/cm7034079.
- ↑ Bruno Fabre, Fanny Hauquier, Cyril Herrier, Giorgia Pastorin, Wei Wu, Alberto Bianco, Maurizio Prato, Philippe Hapiot, Dodzi Zigah: Covalent Assembly and Micropatterning of Functionalized Multiwalled Carbon Nanotubes to Monolayer-Modified Si(111) Surfaces. In: Langmuir. 24. Jahrgang, Nr. 13, 1. Juli 2008, S. 6595–6602, doi:10.1021/la800358w.
- ↑ T Umeyama, J Baek, Y Sato, K Suenaga, F Abou-Chahine, NV Tkachenko, H Lemmetyinen, H Imahori: Molecular interactions on single-walled carbon nanotubes revealed by high-resolution transmission microscopy. In: Nature Communications. 6. Jahrgang, 2015, S. 7732, doi:10.1038/ncomms8732, PMID 26173983, PMC 4518305 (freier Volltext).
- ↑ Hugh Hayden, Yurii K. Gun’ko, Tatiana S. Perova: Chemical modification of multi-walled carbon nanotubes using a tetrazine derivative. In: Chemical Physics Letters. 435. Jahrgang, Nr. 1–3, 12. Februar 2007, S. 84–89, doi:10.1016/j.cplett.2006.12.035.
- ↑ Jason J. Stephenson, Jared L. Hudson, Samina Azad, James M. Tour: Individualized Single Walled Carbon Nanotubes from Bulk Material Using 96% Sulfuric Acid as Solvent. In: Chemistry of Materials. 18. Jahrgang, Nr. 2, 1. Januar 2006, S. 374–377, doi:10.1021/cm052204q.
- ↑ Fuyong Cheng, Patigul Imin, Christian Maunders, Gianluigi Botton, Alex Adronov: Soluble, Discrete Supramolecular Complexes of Single-Walled Carbon Nanotubes with Fluorene-Based Conjugated Polymers. In: Macromolecules. 41. Jahrgang, Nr. 7, 4. März 2008, S. 2304–2308, doi:10.1021/ma702567y.
- ↑ Roberto Martín, Liliana Jiménez, Mercedes Alvaro, Juan C. Scaiano, Hermenegildo Garcia: Two-Photon Chemistry in Ruthenium 2,2′-Bipyridyl-Functionalized Single-Wall Carbon Nanotubes. In: Chemistry: A European Journal. 16. Jahrgang, Nr. 24, 25. Juni 2010, S. 7282–7292, doi:10.1002/chem.200903506.
- ↑ Ralf Graupner, Jürgen Abraham, David Wunderlich, Andrea Vencelová, Peter Lauffer, Jonas Röhrl, Martin Hundhausen, Lothar Ley, Andreas Hirsch: Nucleophilic-Alkylation-Reoxidation: A Functionalization Sequence for Single-Wall Carbon Nanotubes. In: Journal of the American Chemical Society. 128. Jahrgang, Nr. 20, 1. Mai 2006, S. 6683–6689, doi:10.1021/ja0607281, PMID 16704270.
- ↑ a b Zois Syrgiannis, Frank Hauke, Jonas Röhrl, Martin Hundhausen, Ralf Graupner, Yiannis Elemes, Andreas Hirsch: Covalent Sidewall Functionalization of SWNTs by Nucleophilic Addition of Lithium Amides. In: European Journal of Organic Chemistry. 2008. Jahrgang, Nr. 15, 1. Mai 2008, S. 2544–2550, doi:10.1002/ejoc.200800005.
- ↑ F. Liang, A. K. Sadana, A. Peera, J. Chattopadhyay, Z. Gu, R. H. Hauge, W. E. Billups: A Convenient Route to Functionalized Carbon Nanotubes. In: Nano Letters. 4. Jahrgang, Nr. 7, 2004, S. 1257–1260, doi:10.1021/nl049428c, bibcode:2004NanoL...4.1257L.
- ↑ D. Wunderlich, F. Hauke, A. Hirsch: Preferred functionalization of metallic and small-diameter single walled carbon nanotubes via reductive alkylation. In: Journal of Materials Chemistry. 18. Jahrgang, Nr. 13, 2008, S. 1493, doi:10.1039/b716732f.
- ↑ F. Liang, J. M. Beach, K. Kobashi, A. K. Sadana, Y. I. Vega-Cantu, J. M. Tour, W. E. Billups: In Situ Polymerization Initiated by Single-Walled Carbon Nanotube Salts. In: Chemistry of Materials. 18. Jahrgang, Nr. 20, 2006, S. 4764–4767, doi:10.1021/cm0607536.
- ↑ A. Mukherjee, R. Combs, J. Chattopadhyay, D. W. Abmayr, P. S. Engel, W. E. Billups: Attachment of Nitrogen and Oxygen Centered Radicals to Single-Walled Carbon Nanotube Salts. In: Chemistry of Materials. 20. Jahrgang, Nr. 23, 2008, S. 7339–7343, doi:10.1021/cm8014226.
- ↑ T. S. Balaban, M. C. Balaban, S. Malik, F. Hennrich, R. Fischer, H. Rösner, M. M. Kappes: Polyacylation of Single-Walled Nanotubes under Friedel–Crafts Conditions: An Efficient Method for Functionalizing, Purifying, Decorating, and Linking Carbon Allotropes. In: Advanced Materials. 18. Jahrgang, Nr. 20, 17. Oktober 2006, S. 2763–2767, doi:10.1002/adma.200600138.
- ↑ a b Yasuhiko Tomonari, Hiroto Murakami, Naotoshi Nakashima: Solubilization of Single-Walled Carbon Nanotubes by using Polycyclic Aromatic Ammonium Amphiphiles in Water—Strategy for the Design of High-Performance Solubilizers. In: Chemistry: A European Journal. 12. Jahrgang, Nr. 15, 15. Mai 2006, S. 4027–4034, doi:10.1002/chem.200501176.
- ↑ Trevor J. Simmons, Justin Bult, Daniel P. Hashim, Robert J. Linhardt, Pulickel M. Ajayan: Noncovalent Functionalization as an Alternative to Oxidative Acid Treatment of Single Wall Carbon Nanotubes with Applications for Polymer Composites. In: ACS Nano. 3. Jahrgang, Nr. 4, 28. April 2009, S. 865–870, doi:10.1021/nn800860m.
- ↑ Wenrong Yang, Pall Thordarson, J Justin Gooding, Simon P Ringer, Filip Braet: Carbon nanotubes for biological and biomedical applications. In: Nanotechnology. 18. Jahrgang, 17. Oktober 2007, S. 412001, doi:10.1088/0957-4484/18/41/412001.
- ↑ Hui Yang, Shiunchin C. Wang, Philippe Mercier, Daniel L. Akins: Diameter-selective dispersion of single-walled carbon nanotubes using a water-soluble, biocompatible polymer. In: Chemical Communications. Nr. 13, S. 1425, doi:10.1039/B515896F.
- ↑ Ran Chen, Slaven Radic, Poonam Choudhary, Kimberley G. Ledwell, George Huang, Jared M. Brown, Pu Chun Ke: Formation and cell translocation of carbon nanotube-fibrinogen protein corona. In: Applied Physics Letters. 101. Jahrgang, Nr. 13, 24. September 2012, S. 133702, doi:10.1063/1.4756794, PMID 23093808, PMC 3470598 (freier Volltext).
- ↑ Zhijuan Wang, Meiye Li, Yuanjian Zhang, Junhua Yuan, Yanfei Shen, Li Niu, Ari Ivaska: Thionine-interlinked multi-walled carbon nanotube/gold nanoparticle composites. In: Carbon. 45. Jahrgang, Nr. 10, 1. September 2007, S. 2111–2115, doi:10.1016/j.carbon.2007.05.018.