Bindegewebe
Bindegewebe bezeichnet verschiedene Gewebetypen, die in allen Bereichen des Körpers vorkommen und dort vielfältige unterstützende Aufgaben verrichten. Bindegewebe enthält vergleichsweise wenige Zellen.[1] Dafür ist es reich an Zwischenzellmasse.[2] Bindegewebe ist für den Körper unverzichtbar, denn es erhält Organformen aufrecht und schützt vor Beschädigungen, dient als Wasserspeicher und spielt als Ort von Abwehrreaktionen gegen Krankheitserreger eine zentrale Rolle. Die Weichteil-Komponenten des Bindegewebes, die den ganzen Körper als ein umhüllendes und verbindendes Spannungsnetzwerk durchdringen, werden auch als Faszien bezeichnet.
Die verschiedenen Gewebe, die unter dem Oberbegriff Bindegewebe zusammengefasst werden, erscheinen sowohl mit bloßem Auge betrachtet als auch in starker Vergrößerung unter dem Mikroskop sehr unterschiedlich. In der Fachliteratur herrscht keine vollständige Einigkeit darüber, welche Gewebe dem Bindegewebe zuzuordnen sind. Weitreichender Konsens besteht über die Zugehörigkeit von lockerem, straffem, retikulärem, gallertigem und spinozellulärem Gewebe zum Typus des Bindegewebes im engeren Sinn;[2][1] im etwas weiteren Sinne zählen Knorpel- und Knochengewebe als Stützgewebe ebenfalls zum Bindegewebe. Meist wird zusätzlich das Fettgewebe als Sonderform des Bindegewebes betrachtet, seltener auch das Blut und die verschiedenen Typen des Muskelgewebes.

Alle diese Bindegewebstypen entwickeln sich aus dem Mesenchym, das zusammen mit dem gallertigen Bindegewebe auch als „embryonales Bindegewebe“ bezeichnet wird.[3]
Entwicklung
[Bearbeiten | Quelltext bearbeiten]In der Embryonalentwicklung des Menschen entwickeln sich aus dem mittleren Keimblatt (Mesoderm) 34 bis 35 Somiten. Die ventralen und medialen Anteile der Somiten entwickeln sich als Sklerotome weiter und werden zu einem Teil des Mesenchyms.[4] Weiteren Anteil an der Bildung des Mesenchyms hat das Neuroektoderm.[1] Das Mesenchym besteht aus pluripotenten Stammzellen, deren zahlreiche Fortsätze untereinander durch Gap Junctions genannte Kontaktflächen verbunden sind. Die Zellen sind teilungsfreudig und amöboid beweglich. Aus dem Mesenchym entwickeln sich im Laufe der weiteren Embryonalentwicklung die einzelnen Typen des Bindegewebes.
Gemeinsame Merkmale
[Bearbeiten | Quelltext bearbeiten]Bindegewebe besteht aus vergleichsweise wenigen Zellen und viel Zwischenzellsubstanz. In der Zwischenzellsubstanz sind verschiedene Typen von Fasern eingelagert. Die aus fibrillären Proteinen bestehenden Fasern – den Hauptanteil stellen Kollagene[5] – bilden ein dichtes Maschenwerk. Der Raum zwischen den Fasern wird zu großen Teilen von stark quellenden Proteoglykanen gefüllt. Die Funktion der Fasern besteht darin, Zugkräften zu widerstehen, während die Proteoglykane kompressionsdämpfend wirken. Das Zusammenwirken von Fasermaschenwerk und Proteoglykanpuffer bewahrt die Form von Organen.[6]
Die Zwischenzellsubstanz, die auch der Speicherung extrazellulärer Wachstumsfaktoren dient, wird von Fibroblasten hergestellt. Um neues Bindegewebe aufzubauen, können Fibroblasten ihren Standort verändern, worin sie sich von den ortsgebundenen Fibrozyten unterscheiden. Neben den überwiegend ortsständigen Fibroblasten und Fibrozyten gibt es im Bindegewebe auch dauerhaft mobile Zellen, die Teil des Immunsystems sind.
Bindegewebsfasern
[Bearbeiten | Quelltext bearbeiten]Kollagene Fasern
[Bearbeiten | Quelltext bearbeiten]Die zugfesten, aber kaum dehnbaren kollagenen Fasern sind 1 bis 10 Mikrometer, selten bis 20 Mikrometer dick.[7] Im Elektronenmikroskop erkennt man eine Querstreifung, die durch die überlappende Anordnung der Kollagenmoleküle bei der Synthese von Kollagenfibrillen zustande kommt. Die zur Stabilisierung der Fibrillen notwendige Hydroxylierung von Prolinresten kann nur dann vollständig ablaufen, wenn ausreichend Vitamin C vorhanden ist.[8] Bei Mangel an Vitamin C kommt es deshalb zu einer Störung der Kollagensynthese, was in schweren Fällen zu Skorbut führt.
In den Bindegeweben findet sich eine Vielzahl verschiedener Kollagentypen; die wichtigsten sind die Kollagentypen I bis IV:
| Kollagentyp | Form | Vorkommen |
|---|---|---|
| Typ I | fibrillenbildend | in den meisten Bindegewebsformen (z. B. in der Haut, in den Knochen und in den Organstromata) |
| Typ II | fibrillenbildend | im Knorpel |
| Typ III | fibrillenbildend | im retikulären Bindegewebe, im retikulär-faserigen Bindegewebe, in der Lamina fibroreticularis |
| Typ IV | netzwerkbildend | in den Basallaminae |
Eine besondere Untergruppe der kollagenen Fasern sind die retikulären Fasern. Diese aus Kollagen vom Typ III bestehenden Fasern bilden auffallend stark verzweigte Netzwerke. Mit einem Durchmesser von 20 bis 40 Nanometern[9] sind sie deutlich dünner als alle anderen Typen kollagener Fasern. Retikuläre Fasern kommen vor allem im nachfolgend beschriebenen retikulären Bindegewebe vor, aber auch in weiteren Geweben, beispielsweise im Disse-Raum der Leber.
Elastische Fasern
[Bearbeiten | Quelltext bearbeiten]Elastische Fasern bestehen aus dem Glykoprotein Fibrillin und dem darin eingelagerten Protein Elastin. Sie lassen sich – in jede Richtung – um ein Vielfaches ihrer Ausgangslänge dehnen und kehren anschließend wieder zu ihrer ursprünglichen Länge zurück. Möglich wird dies durch die geknäuelte Anordnung des Elastins in den Fasern.[8] Die Dehnbarkeit der elastischen Fasern wird räumlich begrenzt durch in unterschiedlichen Anteilen benachbart vorkommende Kollagenfasern, welche deutlich weniger elastisch sind. Elastische Fasern finden sich in fast jedem Bindegewebstyp, vor allem jedoch im Lungengewebe, in elastischen Arterien und elastischen Bändern (z. B. in den Ligamenta flava).
Elastische Fasern lassen sich lichtmikroskopisch mit speziellen Elastika-Färbungen sichtbar machen.
Bindegewebszellen
[Bearbeiten | Quelltext bearbeiten]Die für Bindegewebe kennzeichnenden Zellen sind Fibroblasten und Fibrozyten. Beide Zelltypen sind oval geformt und über weitverzweigte Zellausläufer miteinander verbunden. Hauptunterscheidungsmerkmal zwischen den beiden Zelltypen ist der Zellkern, welcher bei den aktiveren Fibroblasten deutlich größer erscheint als bei den eher passiven Fibrozyten.
Zwischen den Fasern und den ortsständigen Zellen kommen auch amöboid bewegliche, freie Zellen vor, die vor allem im Dienst des Immunsystems stehen. Diese Zellen stammen aus dem Knochenmark und wandern über die Blutgefäße in das Bindegewebe ein. Teilweise handelt es sich auch um typischerweise im Blut vorkommende Zellen, die dort zu den weißen Blutkörperchen zählen. Die am häufigsten vorkommenden freien Zellen sind:
Bei akuten Entzündungsvorgängen wandern vor allem Granulozyten vermehrt ins Bindegewebe ein, was im Gewebeschnitt unter dem Mikroskop erkennbar wird an der hohen Dichte von Granulozyten zwischen den wenigen Fibroblasten und Fibrozyten.
Spezielle Bindegewebstypen
[Bearbeiten | Quelltext bearbeiten]Lockeres Bindegewebe
[Bearbeiten | Quelltext bearbeiten]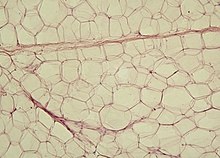
Lockeres Bindegewebe befindet sich als Füllmaterial in diversen Zwischenräumen im Körper und bildet das Stroma, also das Gerüst vieler Organe. Im lockeren Bindegewebe überwiegt meist die Grundsubstanz. Funktionell dient es unter anderem als Wasserspeicher, Verschiebeschicht und Aufenthaltsraum für zahlreiche freie Zellen.
Eine Sonderform des lockeren Bindegewebes ist das Fettgewebe. Im Gegensatz zu anderen Bindegewebstypen ist beim Fettgewebe kaum Interzellulärsubstanz vorhanden. Die spezialisierten Zellen heißen Adipozyten und speichern in ihrem Zytoplasma große Mengen an Fett.
Straffes Bindegewebe
[Bearbeiten | Quelltext bearbeiten]Das straffe Bindegewebe zeichnet sich durch einen hohen Anteil von Kollagenfasern aus – deutlich mehr als im lockeren Bindegewebe. Entsprechend geringer ist der Anteil an Grundsubstanz. Außerdem enthält das straffe Bindegewebe viel weniger Zellen. Es kann nach der Richtung der Kollagenfasern unterteilt werden in straffes geflechtartiges und straffes parallelfasriges Bindegewebe.
Im straffen geflechtartigen Bindegewebe überkreuzen sich die Kollagenfaserbündel vielfach, wodurch Zugfestigkeit in verschiedenen Richtungen erreicht wird.[10] Dieser Typ bildet zum Beispiel Organkapseln, die Lederhaut des Auges und der Haut sowie die harte Hirnhaut.
Das straffe parallelfasrige Bindegewebe bildet Sehnen und Bänder. Die Kollagenfasern sind parallel angeordnet, wodurch hohe Zugfestigkeit in eine Richtung erreicht wird. Die Fibrozyten des Sehnengewebes werden auch als Tendinozyten oder „Flügelzellen“ bezeichnet. Sie besitzen flache und flächige, dreidimensional flügelähnliche Ausläufer, zwischen denen und an denen entlang sich die Kollagenfaserbündel ausrichten.
Retikuläres Bindegewebe
[Bearbeiten | Quelltext bearbeiten]
Das retikuläre Bindegewebe kommt nur in den sekundären lymphatischen Organen (Lymphknoten, Milz, schleimhaut-assoziiertes lymphatisches Gewebe), in der Leber und im Knochenmark vor. Aufgabe dieses Gewebes ist, freien Zellen, vor allem Zellen des Immunsystems, einen Begegnungsraum zur Verfügung zu stellen.
Die Fibroblasten des retikulären Bindegewebes werden fibroblastische Retikulumzellen genannt. Sie bilden ein weites dreidimensionales Netz aus retikulären Fasern. Diese sind aber immer von Ausläufern der Retikulumzellen umhüllt und haben keinen Kontakt zum Interzellularraum.[11] Dies steht im Gegensatz zu anderen Gewebstypen, bei denen zwar auch retikuläre Fasern vorkommen, die aber von den dortigen Fibrozyten in den Interzellularraum abgegeben werden.
Gallertiges (kollagenes) Bindegewebe
[Bearbeiten | Quelltext bearbeiten]Gallertiges Bindegewebe, das auch als kollagenes Bindegewebe bezeichnet wird, besteht aus flachen, verzweigten Fibrozyten, die miteinander ein weitmaschiges Netz bilden. Gallertiges Bindegewebe befindet sich überwiegend im Bereich der Nabelschnur, wo es auch Wharton-Sulze genannt wird. Es tritt außerdem in der Pulpa junger Zähne auf. Die Extrazellularmatrix des gallertigen Bindegewebes enthält feine kollagene und retikuläre Fasern sowie Hyaluronsäure. Letztere kann eine große Menge Wasser an sich binden, wodurch die gallertige Konsistenz zustande kommt, die diesem Bindegewebstyp seinen Namen verliehen hat. Die starke Wassereinlagerung gewährleistet die Schutzfunktion des gallertigen Bindegewebes für die Gefäße in der Nabelschnur, die vor Abschnürung gesichert werden müssen, ohne sie dabei in ihrer Flexibilität zu beeinträchtigen.
Spinozelluläres Bindegewebe
[Bearbeiten | Quelltext bearbeiten]
Das spinozelluläre Bindegewebe kommt in der Rinde des Eierstocks vor. Die Fibrozyten liegen dort dicht beieinander und sind häufig „fischzugartig“ angeordnet. In der spärlichen Interzellularsubstanz kommen einige wenige retikuläre Fasern vor. Aus Fibrozyten des spinozellulären Bindegewebes entstehen bei der Reifung der Eizellen im Ovar die Thekazellen, die die Theca folliculi bilden.
Teilweise wird auch die Schleimhaut der Gebärmutter, das Endometrium, als eine Form des spinozellulären Bindegewebes angesehen.[12]
Stützgewebe
[Bearbeiten | Quelltext bearbeiten]Stützgewebe lässt sich seinerseits in Knorpelgewebe und Knochengewebe unterteilen.
Knorpelgewebe
[Bearbeiten | Quelltext bearbeiten]Knorpelgewebe ist eine spezielle Form des Bindegewebes: Es ist fest, aber druckelastisch, verform- und schneidbar. Die knorpelbildenden Zellen werden Chondrozyten genannt und bilden die Knorpelmatrix. Diese enthält hauptsächlich Kollagen Typ II, aber auch weitere, seltenere Kollagentypen. Weiterhin sorgen Aggrecan und unter anderem die daran gebundene Hyaluronsäure für eine Wasserspeicherung, die für die Konsistenz des Knorpels verantwortlich ist. Auch hier spielt die Konsistenz für die Funktion eine wichtige Rolle: Knorpel hat formgebende Aufgaben, hält unter anderem die Atemwege offen und sorgt in Form von Gelenkknorpel für eine verminderte Reibung. Außerdem werden die meisten Knochen in der Entwicklung zunächst als Knorpelmodell angelegt und erst später verknöchert. Knorpel weist, mit Ausnahme des fetalen Knorpels, keine Versorgung durch Nerven und Blutgefäße auf, sondern wird per Diffusion von der Knorpelhaut (Perichondrium) ernährt.
Man unterscheidet im Einzelnen drei bzw. vier verschiedene Knorpeltypen:
- hyaliner Knorpel
- fetaler Knorpel (lässt sich auch als hyaliner Knorpel mit Blutgefäßen betrachten)[13]
- elastischer Knorpel
- Faserknorpel
Knochengewebe
[Bearbeiten | Quelltext bearbeiten]
Knochengewebe besteht aus einer verkalkten Matrix (Interzellulärsubstanz), die von Osteoblasten gebildet und von Osteoklasten abgebaut wird. Weiterhin kommen Osteoprogenitorzellen (Vorläufer der Osteoblasten) und Osteozyten vor.[14] Die Knochenmatrix besteht zu rund einem Drittel aus organischer Substanz (vor allem Kollagen Typ I). Zwei Drittel der Matrix bestehen aus Hydroxylapatit, einem kristallinen Kalziumsalz, das für die Härte des Knochengewebes verantwortlich ist.
Knochengewebe unterscheidet sich nach der inneren Ordnung der Zellen und Fasern in Geflechtknochen und Lamellenknochen. Im Geflechtknochen sind die Osteozyten unregelmäßig verteilt und die Kollagenfasern der Knochenmatrix sind in groben Bündeln scheinbar ungeordnet ausgerichtet. Er wird meist in geordnet erscheinenden Lamellenknochen umgebaut, der aus einer kompakten äußeren Schicht und einem schwammartige aufgebauten Inneren besteht.
Erkrankungen und Verletzungen
[Bearbeiten | Quelltext bearbeiten]Die Wundheilung geht vom Bindegewebe aus und auch viele Immunreaktionen spielen sich, zumindest teilweise, im Bindegewebe ab. Als typische Bindegewebserkrankungen gelten Kollagenosen, bei denen das Immunsystem sich unspezifisch gegen körpereigene Zellen richtet. Daneben gibt es eine Reihe weiterer Erkrankungen, die speziell das Bindegewebe betreffen.
Erworbene Krankheiten
[Bearbeiten | Quelltext bearbeiten]Wie bereits erwähnt, kommt es bei ausgeprägtem Vitamin-C-Mangel zum Krankheitsbild des Skorbuts.
Zum Abbau von Kollagen kommt es in Hungerperioden, bei Immobilisation oder Schwerelosigkeit, wie auch bei rheumatoider Arthritis und längerer, hochdosierter Cortisongabe.[9]
Bei der Fibrose und Sklerose kommt es zu einer gesteigerten Kollagen(-Typ I)-Synthese, was zu Funktionseinschränkungen oder -verlust des betroffenen Gewebes führt.
Gut- und bösartige Tumoren kommen auch im Bindegewebe vor. Gutartige Tumoren sind hier beispielsweise das Fibrom oder das Lipom, bösartige Tumoren werden unter dem Begriff Sarkome zusammengefasst. Im Einzelnen sind dies z. B. das Fibrosarkom, das Liposarkom oder das Rhabdomyosarkom.[15]
Erbliche Krankheiten
[Bearbeiten | Quelltext bearbeiten]Bei der sogenannten Glasknochenkrankheit (Osteogenesis imperfecta) liegt eine Genmutation vor, die zu einer gestörten Bildung einer Kollagenuntereinheit führt, oder diese ganz verhindert.[8] Die Folge ist eine stark erhöhte Bruchneigung von Knochen.
Die Gruppe der mit dem Ehlers-Danlos-Syndrom beschriebenen Krankheiten sind ebenfalls erbliche Krankheiten. Durch einen Enzymdefekt können Kollagenfibrillen nicht korrekt zusammengebaut werden, was sich in einer Verletzungsneigung und gesteigerten Elastizität der Haut sowie einer Überstreckbarkeit von Gelenken äußert.
Das Marfan-Syndrom ist eine mehr oder weniger ausgeprägte Instabilität aller Bindegewebe des Körpers.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Ulrich Welsch: Lehrbuch Histologie. 2. Auflage. Urban & Fischer bei Elsevier, München 2006, ISBN 3-437-44430-1, S. 108.
- ↑ a b Herbert Lippert: Lehrbuch Anatomie. 7. Auflage. Urban & Fischer bei Elsevier, München 2006, ISBN 3-437-42362-2, S. 25 ff.
- ↑ Norbert Ulfig: Kurzlehrbuch Histologie. 2. Auflage. Thieme, Stuttgart 2005, ISBN 3-13-135572-7, S. 44.
- ↑ Ulrike Bommas-Ebert, Philipp Teubner, Rainer Voß: Kurzlehrbuch Anatomie und Embryologie. 2. Auflage. Thieme, Stuttgart 2005, ISBN 3-13-135532-8, S. 46.
- ↑ J. Myllyharju, K. I. Kivirikko: Collagens, modifying enzymes and their mutations in humans, flies and worms. In: Trends Genet. 20. Jahrgang, Nr. 1, 2004, S. 33–43, PMID 14698617.
- ↑ Eble, J. A.: Antimetastatische Integrin-Inhibitoren. In: BIOspektrum. 6. Jahrgang, 2009, S. 621–623.
- ↑ Ulrich Welsch: Lehrbuch Histologie. 2. Auflage. Elsevier/Urban & Fischer, München 2006, ISBN 3-437-44430-1, S. 118.
- ↑ a b c Werner Müller-Esterl: Biochemie. 1. Auflage. Elsevier/Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-0534-3, S. 126 ff.
- ↑ a b Ulrich Welsch: Lehrbuch Histologie. 2. Auflage. Elsevier/Urban & Fischer, München 2006, ISBN 3-437-44430-1, S. 121.
- ↑ Norbert Ulfig: Kurzlehrbuch Histologie. 2. Auflage. Thieme, Stuttgart 2005, ISBN 3-13-135572-7, S. 41.
- ↑ Ulrich Welsch: Lehrbuch Histologie. 2. Auflage. Urban & Fischer bei Elsevier, München 2006, ISBN 3-437-44430-1, S. 125.
- ↑ Ulrich Welsch: Lehrbuch Histologie. 2. Auflage. Urban & Fischer bei Elsevier, München 2006, ISBN 3-437-44430-1, S. 126.
- ↑ Norbert Ulfig: Kurzlehrbuch Histologie. 2. Auflage. Thieme, Stuttgart 2005, ISBN 3-13-135572-7, S. 47.
- ↑ Ulrich Welsch: Lehrbuch Histologie. 2. Auflage. Urban & Fischer bei Elsevier, München 2006, ISBN 3-437-44430-1, S. 135.
- ↑ Werner Böcker, Helmut Denk, Phillip U. Heitz (Hrsg.): Pathologie. 3. Auflage. Urban & Fischer bei Elsevier, München 2004, ISBN 3-437-44470-0, S. 205 f.