Photorhabdus
| Photorhabdus | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Photorhabdus luminescens | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Photorhabdus | ||||||||||||
Photorhabdus ist eine Gattung von biolumineszierenden, gramnegativen Stäbchenbakterien, die symbiotisch in entomopathogenen (Insekten befallenden) Nematoden lebt.[1]
Photorhabdus ist bekanntlich ein Pathogen für ein breites Spektrum an Insekten und wurde in der Landwirtschaft bereits als Biopestizid verwendet. Die Symbiose mit den Nematoden besteht darin, dass sie deren Larven helfen, die Insekten zu parasitieren.
Etymologie
[Bearbeiten | Quelltext bearbeiten]Der erste Namensbestandteil „photo“ weist auf die Biolumineszenz hin, der zweite „rhabdus“ auf die Stäbchenform.[1]
Beschreibung und Lebenszyklus
[Bearbeiten | Quelltext bearbeiten]Photorhabdus-Arten erleichtern die Vermehrung entomopathogener Nematoden, indem sie anfällige Insektenlarven infizieren und abtöten.[2] Entomopathogene Nematoden sind normalerweise im Boden zu finden. Die Nematoden infizieren die Larven, indem sie deren Cuticula der Larven durchlöchern. Wenn der Nematode in eine Insektenlarve eindringt, werden von ihm die Photorhabdus-Bakterien freigesetzt, die eine Reihe von Toxinen produzieren und den Wirt innerhalb von 48 Stunden abtöten. Die Photorhabdus-Bakterien ernähren sich vom „Kadaver“ des Insekts und verwandeln diesen in eine Nährstoffquelle für den Fadenwurm. Die adulten (ausgewachsenen) Nematoden verlassen den Insektenkörper und suchen sich neue Wirte, die sie befallen können.
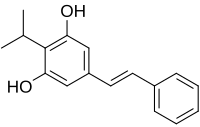
Während der stationären Wachstumsphase in den Insektenlarven produzieren die Photorhabdus-Bakterien ein Toxin namens 3,5-Dihydroxy-4-isopropyl-trans-stilben.[3] Von diesem Stoff wird vermutet, dass er als selektives Antibiotikum wirkt und so Photorhabdus-Bakterien vor der Konkurrenz anderer Mikroorganismen schützt. Außerdem scheint er zu helfen, das Immunsystem des Insekts zu umgehen.[1]
Photorhabdus-Arten sind als Endosymbionten für Heterorhabditis-Nematoden von essentieller Bedeutung.
Evolution
[Bearbeiten | Quelltext bearbeiten]Es wird vermutet, dass die Photorhabdus-Arten die Toxin-Gene im Laufe der Evolution durch horizontalen Gentransfer (HGT) erworben haben.
Bedeutung für die Landwirtschaft
[Bearbeiten | Quelltext bearbeiten]Die Effizienz der Photorhabdus-Arten darin, Insekten zu töten und ihre Eignung als Biopestizid wurden untersucht. Die Verwendbarkeit von Photorhabdus-Arten alleine als Biopestizid, unabhängig von den Nematoden-Symbionten gegen
- den Kleinen Kohlweißling (Pieris rapae),
- den Großen Kohlweißling (Pieris brassicae),
- die Mango-Schmierlaus (Drosicha mangiferae syn. Drosicha stebbingi, (englisch mango mealybug, giant mealybug))[4]
- die Puppen der Kohlschabe (Plutella xylostella, Schleier- und Halbmotten)
wurde erfolgreich gezeigt.[5] Sie haben auch das pathogene Potenzial, den Asiatischen Maiszünsler (Ostrinia furnacalis, en. Asian corn borer), einen Maisschädling in Ostasien, innerhalb von 48 Stunden zu töten.
Krankheitserreger des Menschen
[Bearbeiten | Quelltext bearbeiten]Die ersten drei gefundenen Photohabdus-Spezies sind P. luminescens, P. temperata und P. asymbiotica.
P. asymbiotica ist nachweislich für den Menschen ansteckend. Die Fälle sind bisher (Stand 2008) auf den US-Bundesstaat Texas und die Goldküste Australiens beschränkt und verlaufen meist nicht tödlich.[1] Der erste derartige Fall einer Infektion beim Menschen wurde 1989 von den Centers for Disease Control (CDC) in den Vereinigten Staaten gemeldet.[6][7]
Obwohl es sich bei P. luminescens um ein insektenpathogenes Bakterium handelt, wurde es in Australien gelegentlich beim Menschen aus infizierten Hautläsionen beim Menschen isoliert, die wahrscheinlich von Spinnenbissen herrührten. Im Jahr 1999 wurden in einer Studie insgesamt vier Fälle von P. luminescens-Infektionen im Südosten Australiens gemeldet, einer im Jahr 1994 und drei im Jahr 1998.[7]
Arten
[Bearbeiten | Quelltext bearbeiten]Die Gattung setzt sich gemäß LPSN wie folgt zusammen,[8] teilweise mit Untergliederungen wiedergegeben nach NCBI[9] (Stand: 1. September 2021; die ursprünglichen drei Arten sind fett wiedergegeben):
Gattung Photorhabdus Boemare et al. 1993
- Spezies P. aegyptia Machado et al. 2021
- Spezies P. akhurstii (Fischer-Le Saux et al. 1999) Machado et al. 2018
- Spezies P. asymbiotica Fischer-Le Saux et al. 1999[10]
- Stamm: Photorhabdus asymbiotica ATCC 43949
- Spezies P. australis (Akhurst et al. 2004) Machado et al. 2018
- Subspezies: P. australis DSM 17609
- Subspezies: P. australis subsp. thailandensis
- Spezies P. bodei Machado et al. 2018
- Spezies P. caribbeanensis (Tailliez et al. 2010) Machado et al. 2018
- Spezies P. cinerea (Tóth & Lakatos 2008) Machado et al. 2018
- Spezies P. hainanensis (Tailliez et al. 2010) Machado et al. 2018
- Spezies P. heterorhabditis Ferreira et al. 2014
- Spezies P. kayaii (Hazir et al. 2004) Machado et al. 2018
- Spezies P. khanii (Tailliez et al. 2010) Machado et al. 2018
- Subspezies: P. khanii NC19
- Subspezies: P. khanii subsp. guanajuatensis
- Subspezies: P. khanii subsp. khanii
- Spezies P. kleinii (An & Grewal 2011) Machado et al. 2018
- Spezies P. laumondii (Fischer-Le Saux et al. 1999) Machado et al. 2018
- Subspezies: P. laumondii subsp. clarkei
- Subspezies: P. laumondii subsp. laumondii
- Spezies P. luminescens (Thomas & Poinar 1979) Boemare et al. 1993 – Typus, veraltet: Xenorhabdus luminescens
- Subspezies: P. luminescens NBAII H75HRPL105
- Subspezies: P. luminescens NBAII HiPL101
P. luminescens subsp. akhurstii[10] P. luminescens subsp. laumondii[10]
- Subspezies: P. luminescens subsp. luminescens[10]
- Subspezies: P. luminescens subsp. mexicana
- Subspezies: P. luminescens subsp. sonorensis
- Spezies P. namnaonensis (Glaeser et al. 2017) Machado et al. 2018
- Spezies P. noenieputensis (Ferreira et al. 2013) Machado et al. 2018
- Spezies P. stackebrandtii (An & Grewal 2011) Machado et al. 2018
- Spezies P. tasmaniensis (Tailliez et al. 2010) Machado et al. 2018
- Spezies P. temperata Fischer-Le Saux et al. 1999[10]
- Subspezies: P. temperata J3
- Subspezies: P. temperata subsp. phorame
- Subspezies: P. temperata subsp. temperata
- Stamm P. temperata subsp. temperata M1021
- Stamm P. temperata subsp. temperata Meg1
- Spezies P. thracensis (Hazir et al. 2004) Machado et al. 2018
- … (etliche nicht-klassifiziete mutmaßliche Spezies mit vorläufigen Bezeichnungen)[11]
Photorhabdus luminescens
[Bearbeiten | Quelltext bearbeiten]
Die Typusspezies Photorhabdus luminescens (veraltet Xenorhabdus luminescens) ist ein tödlicher Krankheitserreger für Insekten und bakterieller Symbiont des Fadenwurms Heterorhabditis megidis (Familie Strongyloidea).[12][13] Das Bakterium lebt im Darm dieses entomopathogenen Fadenwurms.
Im Jahr 2003 wurde das vollständige Genom von P. luminescens sequenziert. Die DNA-Sequenz enthält eine Reihe von Genen, die für die Tötung des Insekts nach der Infektion unerlässliche Toxine kodieren. Dazu gehören Gene für Toxine, die beispielsweise den Tabakhornwurm (die Larve des Tabakschwärmers Manduca sexta)[14] abtöten.[15] Insgesamt werden die von P. luminescens abgesonderten Toxine in vier Hauptgruppen eingeteilt:[16]
- Tcs (Toxin complexes, de. Toxische Komplexe)
- Mcf (Makes Caterpillars Floppy toxins, de. etwa „macht Raupen schlaff“), kodiert durch das Gen mcf[15]
- Pir (Photorhabdus insect related proteins)
- PVCs (Photorhabdus Virulence Cassettes)
Im Detail:
- Wenn der Fadenwurm ein Insekt parasitiert, werden die P. luminescens-Bakterien in den Blutkreislauf des Insekts freigesetzt und töten diesen Insektenwirt rasch (innerhalb von 48 Stunden) durch die Produktion von Toxinen wie dem hochmolekularen insektiziden Proteinkomplex Tca (Toxin complex a).[17]
- P. luminescens produziert zudem ein proteinhaltiges Toxin durch die Expression eines einzigen Gens namens makes caterpillars floppy (mcf).[18] Mcf löst die Apoptose in den Hämozyten und im Mitteldarmepithel der Insekten aus.[15] Die Mfc-Toxine haben gezeigt, dass sie auch die Apoptose von Säugetierzellen auslösen können.[19]
- Außerdem sondert das Bakterium Enzyme (Pir) ab , die das Gewebe des infizierten Insekts abbauen und in Nährstoffe umwandeln, die sowohl vom Fadenwurm als auch vom Bakterium genutzt werden können. Auf diese Weise erhalten beide Organismen genügend Nährstoffe, um sich mehrmals zu vermehren. Die Bakterien dringen wieder in die Nachkommen des Fadenwurms ein, wenn diese sich entwickeln. Es gibt zudem Gene, die in die Entwicklung des Insektenwirts eingreifen.[15] Eine Deletion des Gens hfq führt zum Verlust der Produktion von Sekundärmetaboliten.[20]
- Ein weiteres von P. luminescens produziertes Toxin ist 3,5-Dihydroxy-4-isopropyl-trans-Stilben (Tapinarof, Benvitomod). Experimente mit infizierten Larven der Großen Wachsmotte (Galleria mellonella) stützen die Annahme, dass diese Verbindung antibiotische Eigenschaften hat. Diese scheinen dazu beizutragen die Konkurrenz durch andere Mikroorganismen zu minimieren und die Fäulnis des nematodeninfizierten Insektenkadavers zu verhindern.[12]
- Eine wichtige identifizierte Sequenz ist das Gen, das für bestimmte Polyketide und Synthasen nichtribosomaler Peptide kodiert; diese Produkte bewirken als Antibiotika Schutz gegen mikrobielle Konkurrenten.[15]
- Das Genom enthält zudem ein MACPF-Protein, das jedoch nicht lytisch zu sein scheint.[21]
- Es enthält auch das Gen gcvB-RNA, das in eine kleine nicht-kodierende RNA transkribiert (übersetzt) wird, die an der Regulierung einer Reihe von Aminosäure-Transportsystemen sowie von Aminosäure-Biosynthese-Genen beteiligt ist.[22]
P. luminescens ist biolumineszent; der Grund dafür ist jedoch noch nicht ganz geklärt. Es wurde berichtet, dass eine Infektion der Wunden von Soldaten im Amerikanischen Bürgerkrieg mit diesem Bakterium die Wunden zum Leuchten brachte und dass dann das Überleben der Soldaten aufgrund der Produktion von Antibiotika durch P. luminescens gefördert hätte.[23][24] Dies führte zu dem Spitznamen Angel's Glow für dieses Phänomen.[25] Als eine Anwendung wird diese Fähigkeit von P. luminescens als Quelle für die Biolumineszenz-Bildgebung (en. bioluminescence imaging, BLI) genutzt.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Nazzareno Dominelli, Ralf Heermann: Freund oder Feind? — Die zwei Gesichter von Photorhabdus luminescens. In: BIOspektrum. Band 27, Nr. 7, November 2021, S. 690–692, doi:10.1007/s12268-021-1662-9.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Der Allrounder Photorhabdus luminescens: Insektenpathogene Bakterien wirken auch gegen Pilzbefall. Auf: EurekAlert! vom 6. Juli 2022 (am Beispiel Fusarium graminearum).
- Bakterium tötet Larven mit Gift in Seepferdchen-Form. Auf: n-tv.de vom 1. Februar 2024 (Photorhabdus luminescens).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d David J. Clarke: Photorhabdus: shedding light on symbioses. In: Microbiology Today. 35. Jahrgang, Nr. 4, 2008, S. 180–183 (englisch).
- ↑ John G. Gerrard: Photorhabdus Species: Bioluminescent Bacteria as Human Pathogens? In: Emerging Infectious Diseases. 9. Jahrgang, Nr. 2, 2003, doi:10.3201/eid0902.020222, PMID 12603999, PMC 2902266 (freier Volltext) – (englisch).
- ↑ Tapinarof (Synonyme: 3,5-Dihydroxy-4-isopropylstilbene, …), auf ChemIDplus
- ↑ Drosicha stebbingi (giant mealybug) (alles aufklappen!)
- ↑
- ↑ J. J. Farmer, J. H. Jorgensen, P. A. Grimont, R. J. Ackhurst, G. O. Poinar, E. Ageron: Xenorhabdus luminescens (DNA hybridization group 5) from human clinical specimens. In: Journal of Clinical Microbiology. 27. Jahrgang, 1989, S. 1594–600, PMID 2768446, PMC 267621 (freier Volltext) – (englisch).
- ↑ a b Margaret M. Peel, David A. Alfredson, Rodney McDougall, Barry L. Scullie, Raymond J. Akhurst et al.: Isolation, identification, and molecular characterization of strains of Photorhabdus luminescens from infected humans in Australia. In: American Society for Microbiology: Journal of Clinical Microbiology. 37. Jahrgang, 1999, S. 3647–3653, PMID 10523568, PMC 85716 (freier Volltext) – (englisch).
- ↑ LPSN: Photorhabdus Boemare et al. 1993
- ↑ NCBI: Photorhabdus (Boemare et al. 1993) emend. Fischer-Le Saux et al. 1999 (genus); graphisch: Photorhabdus, auf: Lifemap, NCBI Version.
- ↑ a b c d e Marion Fischer-Le Saux, Véronique Viallard, Brigitte Brunel, Phillippe Normand, Noël E.YR 1999 Boemare: Polyphasic classification of the genus Photorhabdus and proposal of new taxa: P. luminescens subsp. luminescens subsp. nov., P. luminescens subsp. akhurstii subsp. nov., P. luminescens subsp. laumondii subsp. nov., P. temperata sp. nov., P. temperata subsp. temperata subsp. nov. and P. asymbiotica sp. nov. In: International Journal of Systematic and Evolutionary Microbiology. Band 49, Nr. 4, September 1999, ISSN 1466-5034, S. 1645–1656, doi:10.1099/00207713-49-4-1645, PMID 10555346.
- ↑ NCBI: unclassified Photorhabdus (list)
- ↑ a b K. Hu, J. M. Webster: Antibiotic production in relation to bacterial growth and nematode development in Photorhabdus--Heterorhabditis infected Galleria mellonella larvae. In: FEMS Microbiology Letters. 189. Jahrgang, Nr. 2, 2000, S. 219–223, doi:10.1111/j.1574-6968.2000.tb09234.x, PMID 10930742 (englisch).
- ↑ NCBI: Heterorhabditis (genus, syn. Chromonema); graphisch: Heterorhabditis, auf: Lifemap, NCBI Version.
- ↑ Grüne Raupe, ein Tabakhornwurm, Manduca sexta, auf einer Tomatenpflanze, auf alamy.de
- ↑ a b c d e Valerie M. Williamson, Harry K. Kaya: Sequence of a symbiont. In: Nature Biotechnology. 21. Jahrgang, Nr. 11, 2003, S. 1924–1925, doi:10.1038/nbt1103-1294, PMID 14595358 (englisch).
- ↑ Athina Rodou, Dennis O. Ankrah, Christos Staphopoulos: Toxins and Secretion Systems of Photorhabdus luminescens. In: Toxins. 2. Jahrgang, Nr. 6. Basel 2010, S. 1250–1264, doi:10.3390/toxins2061250, PMC 3153242 (freier Volltext) – (englisch).
- ↑ Michael B. Blackburn, John M. Domek, Dale B. Gelman, Jing S. Hu: The broadly insecticidal Photorhabdus luminescens toxin complex a (Tca): Activity against the Colorado potato beetle, Leptinotarsa decemlineata, and sweet potato whitefly, Bemisia tabaci. In: Journal of Insect Science. 5. Jahrgang, 1. Januar 2005, S. 32, doi:10.1093/jis/5.1.32, PMID 17119614, PMC 1615239 (freier Volltext) – (englisch, oup.com).
- ↑ Phillip J. Daborn, Nick Waterfield, Carlos Peres Silva, Candy P. Y. Au, Sadhana Sharma, Richard H. ffrench-Constant: A single Photorhabdus gene, makes caterpillars floppy (mcf), allows Escherichia coli to persist within and kill insects. In: Proceedings of the National Academy of Sciences. 99. Jahrgang, Nr. 16, 2002, S. 10742, doi:10.1073/pnas.102068099, PMID 12136122, PMC 125031 (freier Volltext) – (englisch). Epub 22. Juli 2002.
- ↑ Andrea Jane Dowling, Phillip J. Daborn, Nicholas R. Waterfield, Pengbo Wang, Charles H. Streuli, Richard H. ffrench-Constant: The insecticidal toxin Makes caterpillars floppy (Mcf) promotes apoptosis in mammalian cells. In: Cellular Microbiology. 6. Jahrgang, Nr. 4. Oxford April 2004, S. 345–353, doi:10.1046/j.1462-5822.2003.00357.x, PMID 15009026 (englisch).
- ↑ N. J. Tobias, A. K. Heinrich, H. Eresmann, P. R. Wright, N. Neubacher, R. Backofen, H. B. Bode: Photorhabdus-nematode symbiosis is dependent on hfq-mediated regulation of secondary metabolites. In: Environmental Microbiology. 2016, doi:10.1111/1462-2920.13502, PMID 27555343 (englisch).
- ↑ Carlos J. Rosado, Ashley M. Buckle, Ruby H. P. Law, Rebecca E. Butcher, Wan-Ting Kan et al.: A Common Fold Mediates Vertebrate Defense and Bacterial Attack. In: Science. 317. Jahrgang, Nr. 5844, 14. September 2007, S. 1548–1551, doi:10.1126/science.1144706, PMID 17717151 (englisch). Epub 23. August 2007.
- ↑ S. C. Pulvermacher, L. T. Stauffer, G. V. Stauffer: The role of the small regulatory RNA GcvB in GcvB/mRNA posttranscriptional regulation of oppA and dppA in Escherichia coli. In: FEMS Microbiol. Lett. 281. Jahrgang, Nr. 1, April 2008, S. 42–50, doi:10.1111/j.1574-6968.2008.01068.x, PMID 18312576 (englisch).
- ↑ Sharon Durham: Students May Have Answer for Faster-Healing Civil War Wounds that Glowed, Agricultural Research Service, 29. Mai 2001 (englisch).
- ↑ Roberta Kwok: Driller Killer, 21. Januar 2012, S. 40
- ↑ Matt Soniak: Why Some Civil War Soldiers Glowed in the Dark ( des vom 14. Oktober 2012 im Internet Archive), Mental Floss, 5. April 2012. Abgerufen am 1. September 2021 Memento im Webarchiv vom 14. Oktober 2012.