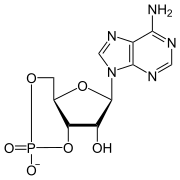
Cyclisches Adenosinmonophosphat
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Cyclisches Adenosinmonophosphat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C10H12N5O6P | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 329,21 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
löslich in Wasser (50 g·l−1)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Cyclisches Adenosinmonophosphat (cAMP) ist ein biochemisch vom Adenosintriphosphat (ATP) abgeleitetes Molekül, das als Second Messenger bei der zellulären Signaltransduktion dient und insbesondere zur Aktivierung vieler Peptidhormone (Proteinkinasen) führt.
cAMP-Synthese und -Abbau
[Bearbeiten | Quelltext bearbeiten]Durch Aktivierung eines G-Protein-gekoppelten Rezeptors durch ein Hormon (z. B. Glucagon), einen Neurotransmitter (z. B. Noradrenalin) oder einen Geruchsstoff wird die membranständige Adenylylcyclase stimuliert. Diese wandelt zelluläres ATP zu cAMP um. Ein bekannter direkter Stimulator der Adenylylcyclase ist Forskolin.
Der Abbau von cAMP zu AMP (Adenosinmonophosphat) wird durch einige Mitglieder aus der Enzymgruppe der Phosphodiesterasen katalysiert. Coffein ist ein unselektiver Inhibitor dieser Enzymgruppe.
Funktionen
[Bearbeiten | Quelltext bearbeiten]Aktivierung von Proteinkinasen
[Bearbeiten | Quelltext bearbeiten]cAMP aktiviert Proteinkinasen vom Typ A (PKA). Diese führen über eine Phosphorylierung verschiedener zellulärer Proteine zu vielfältigen Effekten, z. B.:
- Phosphorylierung von Ca2+-Kanälen, was wiederum die Öffnung derselben bewirkt
- Phosphorylierung der Myosin-Leichtketten-Kinase, was eine Relaxation der glatten Muskulatur bewirkt (Diese Aussage ist nicht mehr aktuell. Es wurde zwar in vitro nachgewiesen, dass PKA durch Hemmung der Myosin-Leichtketten-Kinase die Ca2+-Sensitivität der glatten Muskulatur reduzieren kann, jedoch ist es fraglich, ob dieser Mechanismus in vivo relevant ist)[4]
- Phosphorylierung von Transkriptionsfaktoren, wie z. B. CREB, was die Transkription cAMP-induzierbarer Gene bewirkt
Aktivierung cAMP-regulierter Ionenkanäle
[Bearbeiten | Quelltext bearbeiten]cAMP bindet neben cGMP an eine Gruppe von CNG-Ionenkanälen, die eine wichtige Rolle bei der Verarbeitung olfaktorischer Signale spielen.[5]
Aktivierung von EPAC
[Bearbeiten | Quelltext bearbeiten]EPAC (Exchange Protein activated by cAMP) sind cAMP-bindende Proteine, die als EPAC/cAMP-Komplex den Austausch von GDP gegen GTP katalysieren und somit direkt kleine GTPasen der Ras-Familie (Rap1 und Rap2) aktivieren, was dazu führt, dass MAP-Kinasen aktiviert werden.
Weitere Funktionen des Komplexes beziehen sich u. a. auf die Insulinsekretion aus den B-Zellen des Pankreas.[6]
Stoffwechselregulation
[Bearbeiten | Quelltext bearbeiten]Durch Aktivierung von Proteinkinasen werden zahlreiche Stoffwechselfunktionen reguliert. Beispiele sind der Glykogen-Abbau zu Glucose, die Lipolyse und die Ausschüttung von Gewebshormonen wie Somatostatin.
cAMP in Bakterien
[Bearbeiten | Quelltext bearbeiten]cAMP ist bereits bei Bakterien als Hungersignal (Glucose-Mangelsignal) zu finden, jedoch ist seine Wirkungsweise hier eine völlig andere: das Molekül ist Teil einer Glucose-Repression der Lactose-Verwertung des genannten Regelkreises.
Ist nämlich Glucose (Glc) im Medium vorhanden, so sind die Gene des Lactose-Operons (lac-Operons) ruhiggestellt. Dies ist sinnvoll, da die Verwertung von Lactose (Lac) unter diesen Idealbedingungen überflüssig wäre.
- Es zeigte sich, dass in Gegenwart von Glc die Konzentration an cAMP gering ist;
- Nach Glc-Entzug steigt sie hingegen durch die Aktivierung einer bakteriellen Adenylylcyclase (AC) stark an.
- Unter diesen Bedingungen ist ein Glc-Transportprotein (TP) phosphoryliert (TP-P). Es bildet einen Komplex mit AC und aktiviert dadurch dieselbe. Bei Glc-Überschuss wäre TP-P durch Phosphat-Übertragung an der Entstehung von Glucose-6-phosphat (G-6P) beteiligt und würde (als TP) seinen Einfluss auf die AC verlieren.
- cAMP bindet sodann an das CAP (Katabolit-Aktivator-Protein), auch als CRP (cAMP-Rezeptor-Protein) bezeichnet, das nun als Transkriptionsfaktor die zum lac-Operon gehörigen Gene aktiviert. Dies leitet die Lactose-Aufnahme unter „Hungerbedingungen“ ein.

1. cAMP aktiviert bei Glc-Mangel das CAP-Protein, welches direkt am Promotor (p) bindet und dessen Aktivierung unterstützt;
2. Lac bindet an ein Repressorprotein (REP); dieses löst sich daraufhin von der Operator-Sequenz (o) und gibt die Transkription der Geneinheit lacZYA frei.
Bei Verfügbarkeit von Glc sinkt der cAMP-Spiegel durch Inhibition der Adenylylzyklase (AC). Die Rolle eines Glucose-Transportproteins (TP) bei diesem Vorgang wird im Text beschrieben.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu ADENOSINE CYCLIC PHOSPHATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 30. März 2020.
- ↑ Eintrag zu cyclisches AMP. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ a b c d Eintrag zu Adenosine 3',5'-cyclic monophosphate bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ Robert F. Schmidt (Herausgeber), Florian Lang (Herausgeber), Manfred Heckmann (Hrsg.): Physiologie des Menschen. Springer Berlin Heidelberg; 30. Auflage, (2007).
- ↑ CNG–Kanäle. Universitätsklinikum Jena, abgerufen am 13. Februar 2019.
- ↑ Pingyuan Wang, Zhiqing Liu, Haiying Chen, Na Ye, Xiaodong Cheng, Jia Zhoua: Exchange proteins directly activated by cAMP (EPACs): Emerging therapeutic targets. In: Bioorganic & Medicinal Chemistry Letters. Band 27, Nr. 8, 15. Mai 2017, doi:10.1016/j.bmcl.2017.02.065 (els-cdn.com [PDF; abgerufen am 6. Februar 2019]).
