1,2,4,5-Tetrabrombenzol
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
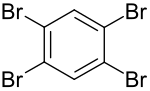
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,2,4,5-Tetrabrombenzol | |||||||||||||||
| Andere Namen |
sym.-Tetrabrombenzol | |||||||||||||||
| Summenformel | C6H2Br4 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 393,70 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,518 g·cm−3 (25 °C)[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
praktisch wasserunlöslich, sehr leicht löslich in Diethylether,[4] löslich in Dimethylsulfoxid, Chloroform[5] und in Benzol[6] | |||||||||||||||
| Brechungsindex |
1,6303 (25 °C, 589 nm)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
1,2,4,5-Tetrabrombenzol ist ein vierfach symmetrisch bromsubstituiertes Benzol. Es gehört mit seinen Isomeren 1,2,3,4-Tetrabrombenzol und 1,2,3,5-Tetrabrombenzol zur Stoffgruppe der Tetrabrombenzole.
Es ist Ausgangsstoff für Flüssigkristalle und OLED-Materialien sowie für Mono-[7] und Bis-Arine.[8] 1,2,4,5-Tetrabrombenzol ist ein wichtiges Abbauprodukt des als Flammschutzmittel eingesetzten vollständig bromierten Benzols Hexabrombenzol im tierischen Organismus mit leberschädigenden Eigenschaften.[9]
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Synthese von 1,2,4,5-Tetrabrombenzol aus Benzol und überschüssigem Brom im verschlossenen Rohr bei 150 °C wurde bereits 1865 berichtet.[10] Der deutlich erniedrigte Erstarrungspunkt von ca. 160 °C weist allerdings auf Verunreinigungen im Endprodukt hin.
Im Jahr 1885 publizierte Adolf Scheufelen in seiner Dissertation die Synthese von 1,2,4,5-Tetrabrombenzol in Gegenwart von Eisen(III)-chlorid FeCl3 als Katalysator und erhielt das reinere Produkt (Smp. 175 °C) „in schönen Nadeln“.[6]
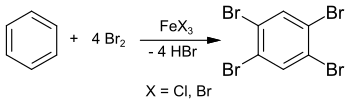
Die Synthese kann auch in Lösung mit Chloroform oder Tetrachlorkohlenstoff erfolgen und liefert 1,2,4,5-Tetrabrombenzol in 89%iger Ausbeute.[11]
Als Lehrbeispiel für elektrophile aromatische Substitutionen kann diese Reaktion auch in einem Laborexperiment mit überschüssigem Brom und Eisennägeln (als Ausgangsmaterial für Eisen(III)-bromid FeBr3) durchgeführt werden.[12] Als Zwischenstufe wird 1,4-Dibrombenzol gebildet, das mit überschüssigem Brom zum 1,2,4,5-Tetrabrombenzol weiter reagiert.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Baustein für Flüssigkristalle und Fluoreszenzfarbstoffe
[Bearbeiten | Quelltext bearbeiten]Das symmetrische Substitutionsmuster mit reaktiven Bromatomen macht 1,2,4,5-Tetrabrombenzol zu einer interessanten Ausgangsverbindung für nematische[13] Flüssigkristalle mit gekreuzten Mesogenen

und für kolumnare (diskotische)[14][15] Flüssigkristalle mit einem ausgedehnt planaren, „brettartigen“ Tetrabenzoanthracen-Ringsystem.

In einer Eintopfreaktion kann aus 1,2,4,5-Tetrabrombenzol mit dem aromatischen Aldehyd 4-Hydroxybenzaldehyd, dem Alkylierungsmittel 1-Brompentan, dem Wittig-Reagenz Methyltriphenylphosphoniumiodid, der Base Kaliumcarbonat, dem Phasentransferkatalysator Tetrabutylammoniumbromid, dem Heck-Reagenz Palladium(II)-acetat und dem Heck-Cokatalysator 1,3-Bis(diphenylphosphino)propan (dppp) in Dimethylacetamid direkt ein symmetrisches Tetraalkoxylstilben als E-Isomer in 17%iger Ausbeute erhalten werden.[16]
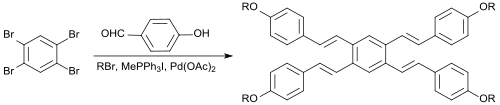
Solche Verbindungen sind als wegen ihrer ausgeprägten π-Konjugation als optische Aufheller, OLED-Materialien oder Flüssigkristalle interessant.
Aus 1,2,4,5-Tetrabrombenzol sind in hohen Ausbeuten N-Alkyl-tetraminobenzole zugänglich, die mit Orthoameisensäuretriethylester und Säuren zu Benzobis(imidazolium)salzen (BBI-Salze) cyclisiert und mit Sauerstoff zu 1,4-Benzochinondiiminen oxidiert werden können.[17]
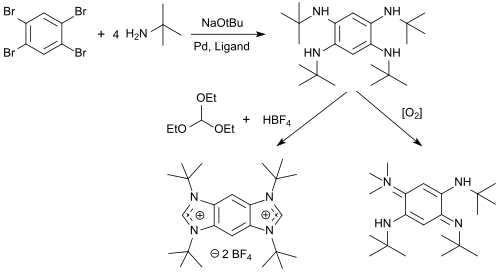
Die BBI-Salze sind vielseitige Fluoreszenzfarbstoffe mit Emissionswellenlängen λem zwischen 329 und 561 nm, ausgeprägter Solvatochromie und starker lösungsmittelabhängiger Stokes-Verschiebung, die als Protein-Tag zur Fluoreszenzmarkierung von Proteinen eingesetzt werden können.[18]
Ausgangsstoff für Arine
[Bearbeiten | Quelltext bearbeiten]Aus 1,2,4,5-Tetrabrombenzol lässt sich mit einem Äquivalent n-Butyllithium durch Bromabstraktion in situ ein 1,4-Monoarin darstellen, das mit Furan sofort unter Bildung von 6,7-Dibrom-1,4-epoxy-1,4-dihydronaphthalin (6,7-Dibromnaphthalin-1,4-endoxid) in 70%iger Ausbeute abgefangen wird.[7]

Bei Verwendung von 2,5-Dialkylfuranen, wie z. B. 2,5-(Di-n-octyl)furan wird das dibromierte Monoendoxid in 64%iger Ausbeute gebildet, aus dem mit Titantetrachlorid/Zink-Staub das 2,3-Dibrom-5,8-di-n-octylnaphthalin mit 88 % Ausbeute entsteht.[19]

Mit Titantetrachlorid/Zink-Staub lässt sich das Endoxid in 86%iger Ausbeute zum 2,3-Dibromnaphthalin reduzieren.[20]

Das Endoxid reagiert mit 3-Sulfolen in einer Diels-Alder-Reaktion unter Abspaltung von Schwefeldioxid zu einem tricyclischen Addukt, aus dem 2,3-Dibromanthracen in guter Ausbeute zugänglich ist.[21]
Lässt man das Dibromendoxid mit weiterem Furan reagieren, dann bildet sich in Gegenwart von n-Butyllithium[7] oder Kaliumamid[22] über ein intermediär gebildetes 1,4-Arin in 71%iger Ausbeute das tricyclische 1,4-bis-Addukt 1,4:5,8-Diepoxy-1,4,5,8-tetrahydroanthracen[23] als syn-anti-Gemisch.

Mit Natriumamid in Ethylenglycoldimethylether DME verhält sich das Dibromendoxid dagegen als 1,3-Arin-Äquivalent und bildet mit Furan ein Phenanthren-artiges tricyclisches 1,3-bis-Addukt, das mit unter Einwirkung von Natriumamid mit Furan zu einem Triphenylen-Derivat (1,3,5-tris-Aren) abgefangen werden kann.[22]

[2+4]-Cycloadditionen mit 1,2,4,5-Tetrabrombenzol verlaufen mitunter in sehr hohen Ausbeuten, wie z. B. einem dihalogensubstituierten 1,3-Diphenyl-isobenzofuran zu einem tetrahalogenierten Anthracen-Derivat (98 %), das sukzessive mit 1,3-Diphenyl-isobenzofuran mit 65%iger Ausbeute zu einem Pentacen- und dieses mit Furan zu einem Hexacen-Derivat (67 %) überführt werden kann.[24]

Die Vernetzung von benzimidazolmodifizierten Polymeren liefert Materialien mit hohem Aufnahmevermögen für Kohlendioxid, die sich zur CO2-Abtrennung aus Gasgemischen eignen könnten.[25]

Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]1,2,4,5-Tetrabrombenzol ist ein lebertoxisches Abbauprodukt des Flammschutzmittels Hexabrombenzol und wurde bereits 1987 in Japan in Muttermilchproben nachgewiesen.[26]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu 1,2,4,5-Tetrabromobenzene bei TCI Europe, abgerufen am 7. Juli 2017.
- ↑ a b c d Datenblatt 1,2,4,5-Tetrabrombenzol bei Sigma-Aldrich, abgerufen am 7. Juli 2017 (PDF).
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 88.
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2017, ISBN 978-1-4987-5429-3, S. 3–494.
- ↑ Eintrag zu 1,2,4,5-Tetrabromobenzene bei Toronto Research Chemicals, abgerufen am 7. Juli 2017 (PDF).
- ↑ a b A. Scheufelen: Ueber Eisenverbindungen als Bromüberträger. In: Liebigs Ann. Chem. Band 231, Nr. 2, 1885, S. 152–195, doi:10.1002/jlac.18852310204.
- ↑ a b c H. Hart, A. Bashir-Hashemi, J. Luo, M.A. Meador: Iptycenes: Extended triptycenes. In: Tetrahedron. Band 42, Nr. 6, 1986, S. 1641–1654, doi:10.1016/S0040-4020(01)87581-5.
- ↑ K. Shahlai, S.O. Acquaah, H. Hart: USE OF 1,2,4,5-TETRABROMOBENZENE AS A 1,4-BENZADIYNE EQUIVALENT: anti- AND syn-1,4,5,8-TETRAHYDROANTHRACENE 1,4:5,8-DIEPOXIDES In: Organic Syntheses. 75, 1998, S. 201, doi:10.15227/orgsyn.075.0201; Coll. Vol. 10, 2004, S. 678 (PDF).
- ↑ E. Bruchajzer, B. Frydrych, J.A. Szymanska: Effect of repeated administration of hexabromobenzene and 1,2,4,5-tetrabromobenzene on the levels of selected cytochromes in rat liver. In: Int. J. Occup. Med. Environ. Health. Band 17, Nr. 3, 2004, S. 347–353, doi:10.1016/S0040-4020(01)87581-5.
- ↑ A. Riche, P. Bérard: Ueber die bromhaltigen Derivate des Benzols und seiner Homologen. In: Liebigs Ann. Chem. Band 133, Nr. 1, 1865, S. 51–54, doi:10.1002/jlac.18651330106.
- ↑ Patent US2979537: Selective bromination of benzene. Angemeldet am 4. Februar 1959, veröffentlicht am 11. April 1961, Anmelder: The Dow Chemical Co., Erfinder: A.A. Asadorian.
- ↑ B. Cox, D.G. Kubler, C.A. Wilson: Experiments with electrophilic aromatic substitution reactions. In: J. Chem. Educ. Band 54, Nr. 6, 1977, S. 379, doi:10.1021/ed054p379.
- ↑ H.-H. Chen et al.: Enantiotropic nematics from cross-like 1,2,4,5-tetrakis(4’-alkyl-4-ethynylbiphenyl) benzenes and their biaxiality studies. In: Chemistry – A European Journal. Band 18, Nr. 31, 2012, S. 9543–9551, doi:10.1002/chem.201103453.
- ↑ S. Kumar: Chemistry of discotic liquid crystals: from monomers to polymers. CRC Press, Boca Raton, FL, U.S.A. 2011, ISBN 978-1-4398-1145-0, S. 200.
- ↑ M.C. Artal, K.J. Toyne, J.W. Goodby, J. Barbera, D.J. Photinos: Synthesis and mesogenic properties of novel board-like liquid crystals. In: J. Mater. Chem. Band 11, 2011, S. 2801–2807, doi:10.1039/B105351P.
- ↑ K.N. Patel, B.V. Kamath, A.V. Bedekar: Synthesis of alkyloxy stilbenes by one-pot O-alkylation-Wittig and O-alkylation-Wittig-Heck reaction sequence. In: Tetrahedron Lett. Band 54, Nr. 1, 2013, S. 80–84, doi:10.1016/tetlet.2012.10.102.
- ↑ D.M. Khramov, A.J. Boydston, C.W. Bielawski: Highly efficient synthesis and solid-state characterization of 1,2,4,5-tetrakis(alkyl- and arylamino)benzenes and cyclization to their respective benzobis(imidazolium) salts. In: Org. Lett. Band 8, Nr. 9, 2006, S. 1831–1834, doi:10.1021/ol060349c.
- ↑ A.J. Boydston: Modular fluorescent benzobis(imidazolium)saltes: Syntheses, photophysical analyses, and applications. In: J. Am. Chem. Soc. Band 130, Nr. 10, 2008, S. 3143–3156, doi:10.1021/ja7102247.
- ↑ Z. Chen, P. Müller, T.M. Swager: Syntheses of soluble, π-stacking tetracene derivatives. In: Org. Lett. Band 8, Nr. 2, 2006, S. 273–276, doi:10.1021/ol0526468.
- ↑ H. Hart, C.-Y. Lai, G.C. Nwokogu, S. Shamouilian: Tetrahalobenzenes as diaryne equivalents in polycyclic arene synthesis. In: Tetrahedron. Band 43, Nr. 22, 1987, S. 5203–5224, doi:10.1016/S0040-4020(01)87696-1.
- ↑ C.-T. Lin, T.-C. Chou: Synthesis of 2,3-dibromoanthracene. In: Synthesis. Band 1988, Nr. 8, 1988, S. 628–630, doi:10.1055/s-1988-27659.
- ↑ a b F. Raymo, F.H. Kohnke, F. Cardullo: The regioselective generation of arynes from polyhalogenobenzenes. An improved synthesis of syn- and anti-1,4,5,8,9,12-hexahydro-1,4:5,8:9,12-triepoxytriphenylene. In: Tetrahedron. Band 48, Nr. 33, 1992, S. 6827–6838, doi:10.1016/S0040-4020(01)89874-4.
- ↑ H. Hart, N. Raju, M.A. Meador, D.L. Ward: Synthesis of heptiptycenes with face-to-face arene rings via a 2,3:6,7-anthradiyne equivalent. In: J. Org. Chem. Band 48, Nr. 23, 1983, S. 4357–4360, doi:10.1021/jo00171a039.
- ↑ S. Eda, T. Hamura: Selective Halogen-Lithium Exchange of 1,2-Dihaloarenes for Successive [2+4] Cycloadditions of Arynes and Isobenzofurans. In: Molecules. Band 20, 2015, S. 19449–19462, doi:10.3390/molecules201019449.
- ↑ S. Altarawneh, S. Behera, P. Jena, H.M. El-Kaderi: New insights into carbon dioxide interactions with benzimidazole-linked polymers. In: Chem. Commun. Band 50, 2014, S. 3571–3574, doi:10.1039/C3CC45901B.
- ↑ T. Miyazaki, T. Yamagishi, M. Matsumoto: Determination and residual levels of 1,2,4,5-tetrabromobenzene and Mirex in human milk samples. In: Food Hygiene and Safety Science. Band 28, Nr. 2, 1987, S. 125–129, doi:10.3358/shokueishi.28.125.
