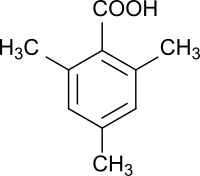
2,4,6-Trimethylbenzoesäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,4,6-Trimethylbenzoesäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H12O2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer bis beiger Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 164,20 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
2,4,6-Trimethylbenzoesäure ist eine aromatische mit drei Methylgruppen substituierte Carbonsäure, deren Carboxygruppe durch zwei orthoständige Methylgruppen sterisch gehindert ist.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Eine Synthese von 2,4,6-Trimethylbenzoesäure geht aus von Brommesitylen, das in Gegenwart von 2-molarem Ethylbromid mit Magnesium-Spänen in Diethylether zur entsprechenden Grignard-Verbindung umgesetzt wird. Die Etherphase wird auf Trockeneis gegossen, wobei in einer Grignard-Reaktion das Magnesiumbromidsalz der 2,4,6-Trimethylbenzoesäure gebildet wird. Anschließendes Ansäuern führt zur Ausfällung der Carbonsäure, die zur Reinigung in Natronlauge aufgenommen und durch erneutes Ansäuern ausgefällt wird.[3]
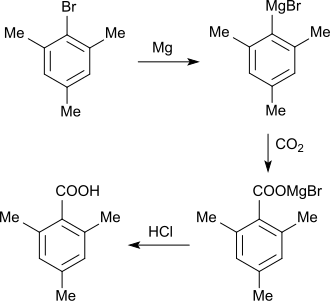
2,4,6-Trimethylbenzoesäure wird in 86–87%iger Ausbeute erhalten, die Umkristallisation aus 45%igem Methanol liefert die aromatische Carbonsäure in langen Nadeln in 84–86%iger Ausbeute.
Die konventionelle Variante der Grignard-Reaktion mit Iod zum Starten der Reaktion liefert lediglich 55–61 % reine 2,4,6-Trimethylbenzoesäure.[4]
Die Umsetzung von Mesitylen (aus Aceton und Schwefelsäure)[5] mit Oxalylchlorid[6] in Kohlenstoffdisulfid bei 10–15 °C und anschließend bei 40 °C in Gegenwart von Aluminiumchlorid liefert Mesitylencarbonsäure in Ausbeuten von 65–76 %.

Dabei bildet sich zunächst Phenylglyoxylsäurechlorid, das leicht zum Mesitylencarbonsäurechlorid decarbonyliert und anschließend mit wässriger Salzsäure zur Carbonsäure hydrolysiert wird. Die Handhabung von CS2 und von molaren Mengen an wasserfreiem AlCl3, sowie die Entwicklung von Chlorwasserstoff und insbesondere von Kohlenmonoxid machen diesen Reaktionsweg für eine technische Synthese unbrauchbar.
Die Pd(II)-katalysierte Carboxylierung von Aromaten mit Ameisensäure in Gegenwart von Phosphenium-Salzen führt in Ausbeuten bis 93 % zu aromatischen Carbonsäuren, darunter auch 2,4,6-Trimethylbenzoesäure.[7]
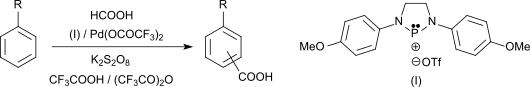
Mesitylen ist auch einer Friedel-Crafts-artigen elektrophilen aromatischen Substitution mit Kohlendioxid in Gegenwart von Silyliumboraten zugänglich und liefert 2,4,6-Trimethylbenzoesäure in 66%iger Ausbeute.[8]

Ein zweistufiger technischer Prozess führt von Mesitylen durch Friedel-Crafts-Acylierung mit Chloressigsäurechlorid in Gegenwart katalytischer Mengen Eisen(III)-oxid zu α-Chlor-2,4,6-trimethylacetophenon.[9]

In einer Einhorn-Reaktion wird das erhaltene Chlormethylketon mit alkalischer Natriumhypochlorit-Lösung sowie weiterer Alkalicarbonatlösung und einem Phasentransferkatalysator, z. B. Dimethyldibenzylammoniumchlorid versetzt und nach Einleiten von Chlor zum Rückfluss erhitzt. Nach Isolierung, Reinigung und Trocknung wird 2,4,6-Trimethylbenzoesäure in 90%iger Ausbeute erhalten.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2,4,6-Trimethylbenzoesäure ist ein weißer, geruchloser, in langen Nadeln kristallisierender Feststoff, der in Wasser wenig und in Alkoholen gut löslich ist.
Wegen der sterischen Hinderung der Carboxygruppe durch die beiden orthoständigen Methylgruppen kann 2,4,6-Trimethylbenzoesäure nicht auf herkömmlichem Wege unter saurer Katalyse verestert werden. Die Carbonsäure löst sich in 96%iger konzentrierter Schwefelsäure unter Bildung eines Acylium-Ions, das in einer zweistufigen und trimolekularen Gleichgewichtsreaktion durch nucleophilen Angriff des Alkohols zum Ester reagiert.[10]

Verwendung
[Bearbeiten | Quelltext bearbeiten]Die Darstellung von Estern der 2,4,6-Trimethylbenzoesäure gelingt durch Umsetzung mit dem aus dem Peptid-Reagenz Diisopropylcarbodiimid und einem Alkohol gebildeten O,N,N′-trisubstituierten Isoharnstoff in Gegenwart von Kupfer(II)-chlorid.[11]

Der Ethylester der Mesitylencarbonsäure ist auch durch Reaktion mit Ethyliodid in Gegenwart äquimolarer Mengen von DBU in 80%iger Ausbeute zugänglich.[12]
Wegen der sterisch anspruchsvollen Struktur und der hohen Stabilität gegen Basenhydrolyse wird die Mesitoylgruppe als Schutzgruppe für Hydroxygruppen in der Naturstoffchemie eingesetzt. Zur Einführung der Mesitoyl-Schutzgruppe eignet sich das gemischte Anhydrid von 2,4,6-Trimethylbenzoesäure mit Trifluoressigsäure. Die erhaltenen Ester können schonend mit Lithiumaluminiumhydrid LiAlH4 oder Aluminiumhydrid AlH3 gespalten werden.[13]
Alkylester der Mesitylencarbonsäure können auch durch ein Gemisch aus gepulvertem Kaliumhydroxid und dem Phasentransferkatalysator Aliquat 336 (Methyltrioctylammoniumchlorid) mit hohen Ausbeuten (Methylester: 93 %, n-Octylester: 87 %) hydrolysiert werden.[14]
Das aus Mesitylencarbonsäure mit Thionylchlorid in 90–97%iger Ausbeute anfallende Mesitoylchlorid[4]

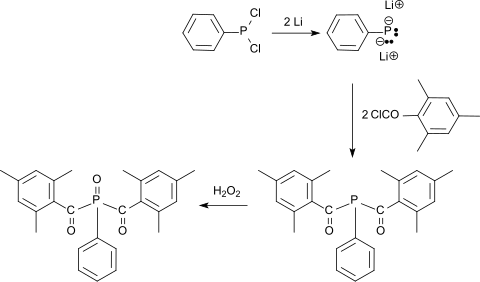
ist eine wichtige Ausgangsverbindung für die Herstellung so genannter UV-Initiatoren vom Acylphosphinoxid-Typ, die durch Bestrahlung mit sichtbaren bzw. UV-Licht in Radikale zerfallen und Kettenpolymerisationen auslösen. Für diese UV-Strahlenhärtung (engl. UV curing) werden u. a. die so genannten Mono-Acylphosphinoxide (MAPO), wie z. B. Trimethylbenzoyldiphenylphosphinoxid TPO eingesetzt, die aus Chlordiphenylphosphan nach Lithiierung und Reaktion mit molaren Mengen Mesitoylchlorid zum 2,4,6-Trimethylbenzoyl-diphenylphosphan und anschließender Oxidation mit Wasserstoffperoxid zum Phosphanoxid TPO erhalten werden[15]
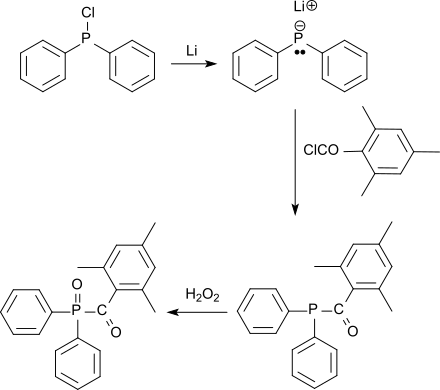
Als Vertreter der so genannten Bis-Acylphosphinoxide (BAPO) kann Bis(2,4,6-Trimethylbenzoyl)phenylphosphinoxid aus Dichlorphenylphosphan nach Lithiierung und Umsetzung mit zweimolaren Mengen Mesitoylchlorid zum Bis-2,4,6-Trimethylbenzoyl-phenylphosphan und anschließender Oxidation mit Wasserstoffperoxid zum Phosphanoxid erhalten werden, die sich durch geringe Flüchtigkeit und Geruchsarmut auszeichnen.[15]
Bestrahlung mit zwei UV-Photonen erzeugen aus einem Photoinitiatormolekül vom BAPO-Typ vier polymerisationsaktive Radikale. Bis-Acylphosphinoxide sind daher hochwirksame Radikalstarter, die sich auch für die Durchhärtung (engl. through cure) von dicken und stark pigmentierten Beschichtungssystemen eignen.[16]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt 2,4,6-Trimethylbenzoesäure zur Synthese bei Sigma-Aldrich, abgerufen am 10. April 2016 (PDF).
- ↑ a b c G.S. Hamilton: 2,4,6-Trimethylbenzoic acid. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rt270.
- ↑ D.M. Bowen: Mesitoic Acid, [β-Isodurylic acid], [I. METHOD A] In: Organic Syntheses. 21, 1941, S. 77, doi:10.15227/orgsyn.021.0077; Coll. Vol. 3, 1955, S. 553 (PDF).
- ↑ a b R.P. Barnes: [II. METHOD B], [Mesitoic Acid and Mesitoyl Chloride] In: Organic Syntheses. 21, 1941, S. 77, doi:10.15227/orgsyn.021.0077; Coll. Vol. 3, 1955, S. 553 (PDF).
- ↑ R. Adams, R. W. Hufferd: Mesitylene In: Organic Syntheses. 2, 1922, S. 41, doi:10.15227/orgsyn.002.0041; Coll. Vol. 1, 1941, S. 341 (PDF).
- ↑ P.E. Sokol: Mesitoic Acid In: Organic Syntheses. 44, 1964, S. 69, doi:10.15227/orgsyn.044.0069; Coll. Vol. 5, 1973, S. 706 (PDF).
- ↑ K. Sakakibara, M. Yamashita, K. Nozaki: An efficient Pd(II)-based catalyst system for carboxylation of aromatic C–H bond by addition of a phosphenium salt. In: Tetrahedron Lett. Band 46, Nr. 6, 2005, S. 959–962, doi:10.1016/j.tetlet.2004.12.027.
- ↑ M. Konno, M. Chiba, K. Nemoto, T. Hattori: Electrophilic aromatic substitution of arenes with CO2 mediated by R3SiB(C6F5)4. In: Chem. Lett. Band 41, Nr. 9, 2012, S. 913–914, doi:10.1246/cl.2012.913.
- ↑ Patent US5296636: Preparation of 2,4,6-trimethylenzoic acid. Angemeldet am 28. Januar 1993, veröffentlicht am 22. März 1994, Anmelder: BASF AG, Erfinder: W. Siegel, R. Kropp, J. Schroeder.
- ↑ H. Shi, Y. Wang, R. Hua: Acid-catalyzed carboxylic acid esterification and ester hydrolysis mechanism: acylium ion as a sharing active intermediate via a spontaneous trimolecular reaction based on density functional theory calculation and supported by electrospray ionization-mass spectrometry. In: Phys. Chem. Chem. Phys. Band 41, Nr. 9, 2012, S. 913–914, doi:10.1246/cl.2012.913.
- ↑ E. Däbritz: Syntheses and Reactions of O,N,N′-Trisubstituted Isoureas. In: Angew. Chem. Band 5, Nr. 5, 1966, S. 470–477, doi:10.1002/anie.196604701.
- ↑ J. Otero, J. Nishikido: Esterification: Methods, Reactions, and Applications, 2nd Edition. Wiley-VCH, Weinheim 2010, ISBN 978-3-527-32289-3, S. 182.
- ↑ S. Cai, S. Hakomori, T. Toyokuni: Application of protease-catalyzed regioselective esterification in synthesis of 6‘-deoxy-6‘-fluoro- and 6-deoxy-6-fluorolactosides. In: J. Org. Chem. Band 57, Nr. 12, 1992, S. 3431–3437, doi:10.1021/jo00038a036.
- ↑ A. Loupy, M. Pedoussant, J. Sansoulet: Solid-liquid phase-transfer catalysis without solvent: mild and efficient conditions for saponifications and preparations of hindered esters. In: J. Org. Chem. Band 51, Nr. 5, 1986, S. 740–745, doi:10.1021/jo00355a032.
- ↑ a b Patent WO2000032612: Process for preparing acylphosphines and derivatives. Angemeldet am 20. November 1999, veröffentlicht am 8. Juni 2000, Anmelder: Ciba Specialty Chemicals Holding Inc., Erfinder: D. Leppard, E. Eichenberger, R. Kaeser, G. Hug, U. Schwendimann.
- ↑ P. Glöckner, T. Jung, S. Struck, K. Studer: Radiation Curing for Coatings and Printing Inks: Technical Basics and Applications. Vincentz Network, Hannover 2008, ISBN 978-3-86630-907-4, S. 37–39.