Collins-Reagenz

Das Collins-Reagenz ist ein Komplex von Pyridin an Chrom(VI)-oxid. Es ist ein dunkelroter, hygroskopischer Feststoff. Wird Collins-Reagenz in Pyridin gelöst, spricht man vom Sarett-Reagenz, das in der Sarett-Oxidation eingesetzt wird.
Es dient der selektiven Oxidation primärer Alkohole zu Aldehyden, welche unter anderen Bedingungen zu Carbonsäuren weiter oxidiert werden würden. Neben primären Alkoholen, kann das Collins-Reagenz auch sekundäre Alkohole zu Ketonen oxidieren[1]. Oxidationsreaktionen mit dem Collins-Reagenz werden auch als Collins-Oxidation bezeichnet. Das Reagenz wurde erstmals 1968 vorgestellt und stellt einen Fortschritt zu vorherigen Methoden dar, da es Dichlormethan als Lösungsmittel nutzt. Dies erlaubt die Nutzung des Oxidationsmittels für eine breitere Palette an Basen-empfindlichen Substraten.
Das Collins-Reagenz toleriert die Anwesenheit vieler funktioneller Gruppen. Es wird meist im Überschuss von vier bis sechs Äquivalenten eingesetzt.[2]
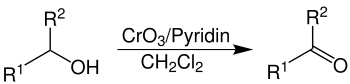
Zur Vermeidung von Verlusten an Aldehyd durch Adduktbildung mit ausfallenden reduzierten Chromspezies kann vor der Bildung des Collins-Reagenz Kieselgel oder Kieselgur hinzugegeben werden. Für die Oxidation empfindlicher Substrate (beispielsweise Kohlenhydrate oder Nukleoside) können durch Zugabe von Essigsäureanhydrid mildere Reaktionsbedingungen geschaffen werden. So werden β-Eliminierungen in Gegenwart von Heteroatomen in β-Position vermieden.[2]
Weitere Chrom(VI)-komplexe mit Pyridin, welche als Oxidationsmittel eingesetzt werden, sind Pyridiniumchlorochromat und das Cornforth-Reagenz.
Herstellung[Bearbeiten | Quelltext bearbeiten]
Das feste Collins-Reagenz wird durch direkte Reaktion von Pyridin und Chrom(VI)-oxid hergestellt.[3] Soll das Collins-Reagenz in Dichlormethan verwendet werden, können auch Chrom(VI)-oxid und Pyridin im stöchiometrischen Verhältnis in wasserfreies Dichlormethan gegeben werden.[2][4] In diesem Fall wird es auch als Ratcliffe-Reagenz bezeichnet.[5]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Oxidation of Alcohols to Aldehydes and Ketones (= Basic Reactions in Organic Synthesis). Springer-Verlag, New York 2006, ISBN 978-0-387-23607-0, S. 20–27, doi:10.1007/b135954 (springer.com [abgerufen am 13. Februar 2022]).
- ↑ a b c G. Tojo, M. Fernández: Oxidation of alcohols to aldehydes and ketones, 2. Auflage, S. 20–27, Springer Verlag, Berlin, ISBN 0-387-23607-4.
- ↑ J. C. Collins and W. W. Hess: ALDEHYDES FROM PRIMARY ALCOHOLS BY OXIDATION WITH CHROMIUM TRIOXIDE: HEPTANAL In: Organic Syntheses. 52, 1972, S. 5, doi:10.15227/orgsyn.052.0005 (PDF).
- ↑ R. W. Ratcliffe: OXIDATION WITH THE CHROMIUM TRIOXIDE-PYRIDINE COMPLEX PREPARED in situ: 1-DECANAL In: Organic Syntheses. 55, 1976, S. 84, doi:10.15227/orgsyn.055.0084 (PDF).
- ↑ Bradford P. Mundy, Michael G. Ellerd, Frank G. Favalorro Jr.: Name Reactions and Reagents in Organic Synthesis. 2. Auflage, Wiley-VCH, 2005, ISBN 978-0-471-22854-7, S. 739.
Literatur[Bearbeiten | Quelltext bearbeiten]
- J. C. Collins, W. W. Hess: Aldehydes from Primary Alcohols by Oxidation with Chromium Trioxide: Heptanal In: Organic Syntheses. 52, 1972, S. 5, doi:10.15227/orgsyn.052.0005; Coll. Vol. 6, 1988, S. 644 (PDF).
