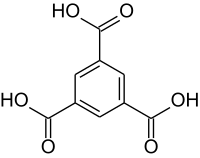
Trimesinsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Trimesinsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C9H6O6 | |||||||||||||||||||||
| Kurzbeschreibung |
beiger Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 210,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
löslich in Wasser und Ethanol[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Trimesinsäure ist neben der Hemimellitsäure (1,2,3-Benzoltricarbonsäure) und der Trimellitsäure (1,2,4-Benzoltricarbonsäure) eine der drei möglichen Stellungsisomere der Benzoltricarbonsäuren.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Trimesinsäure wird durch Oxidation von Mesitylen hergestellt.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Trimesinsäure ist ein beiger Feststoff,[1] der löslich in Wasser ist. Er ist in der Lage eine Vielzahl von Komplexen durch Wasserstoffbrückenbindungen zu bilden und kommt in zwei Hydratformen (Dihydrat und 5/6 Hydrat) vor.[4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Trimesinsäure ist ein wichtiger Grundstoff zur Synthese von Lackharzen, Weichmachern, Polyestern, Zusatz zu Epoxid-Harzen, Farbstoffen usw. Er wird zur Modifikation von linearen Polyestern verwendet.[5] Außerdem wird Trimesinsäure als Linker für die Synthese von Metall-organischen Gerüstverbindungen eingesetzt (z. B. HKUST-1 oder MIL-100). In den resultierenden Gerüststrukturen ist die deprotonierte Form (1,3,5-Benzoltricarboxylat, BTC) eingebaut und in den meisten Fällen koordinieren alle drei Carboxylatgruppen an die entsprechenden Metallzentren.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Trimesic acid bei Sigma-Aldrich, abgerufen am 14. Dezember 2012 (PDF).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-38.
- ↑ Eintrag zu Trimesinsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. November 2014.
- ↑ Jonathan W. Steed, Jerry L. Atwood: Supramolecular Chemistry. John Wiley & Sons, 2009, ISBN 0-470-74089-2, S. 399 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Harry H. Szmant: Organic Building Blocks of the Chemical Industry. John Wiley & Sons, 1989, ISBN 0-471-85545-6, S. 480 (eingeschränkte Vorschau in der Google-Buchsuche).
