Bariumacetat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
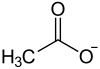
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bariumacetat | ||||||||||||||||||
| Summenformel | C4H6BaO4 | ||||||||||||||||||
| Kurzbeschreibung |
weiße geruchlose Kristalle,[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | |||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Bariumacetat ist eine chemische Verbindung aus der Gruppe der Bariumverbindungen und Acetate mit der Konstitutionsformel Ba(CH3COO)2.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Bariumacetat kann durch Reaktion von Bariumcarbonat oder Bariumsulfid mit Essigsäure dargestellt werden.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bariumacetat existiert in drei unterschiedlichen Kristallstrukturen: unterhalb von 24,7 °C als Trihydrat (CH3COO)2Ba · 3 H2O im monoklinen Kristallsystem, zwischen 24,7 °C und 41 °C als Monohydrat (CH3COO)2Ba · H2O im triklinen Kristallsystem und oberhalb von 41 °C in Form des wasserfreien Salzes.[2] Letzteres kristallisiert im tetragonalen Kristallsystem in der Raumgruppe I41/a (Raumgruppen-Nr. 88) mit den Gitterparametern a = 990,1 pm und b = 2736,2 pm. In der Elementarzelle befinden sich 16 Formeleinheiten.[8] Die Kristalle des Anhydrats sind nicht hygroskopisch.[4] Die Löslichkeitskurve hat in den Umwandlungspunkten deutliche Knicke.[9]
Die Standardbildungsenthalpie von Bariumacetat beträgt −1486 kJ/mol.[4]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt Bariumacetat bei Alfa Aesar, abgerufen am 2. Juni 2010 (Seite nicht mehr abrufbar).
- ↑ a b Dale L. Perry, Sidney L. Phillips: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 45 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Datenblatt Bariumacetat bei Merck, abgerufen am 2. Juni 2010.
- ↑ a b c Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 323 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Eintrag zu Bariumacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag barium salts, with the exception of barium sulphate, salts of 1-azo-2-hydroxynaphthalenyl aryl sulphonic acid, and of salts specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ R. Abegg, F. Auerbach: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, Bd. 2, 1908. S. 287f.Volltext
- ↑ I. Gautier-Luneau, A. Mosset: Crystal structure of anhydrous barium acetate. In: Journal of Solid State Chemistry 1988, 73(2), S. 473–479. doi:10.1016/0022-4596(88)90133-8
- ↑ Georg Bredig, Wilhelm Bachmann: "Handbuch der angewandten physikalischen Chemie in Einzeldarstellungen, 1907. Verlag J.A. Barth, Band 5, S. 89. Volltext

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)


