Cinnolin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cinnolin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H6N2 | |||||||||||||||
| Kurzbeschreibung |
farblose Nadeln[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 130,15 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Cinnolin ist eine organische Verbindung, die zu den Heterocyclen (genauer: Heteroaromaten und Diazanaphthalinen) zählt. Die Verbindung besteht aus einem Benzolring, an dem ein Pyridazinring anelliert ist. Cinnolin ist isomer zu Chinazolin, Chinoxalin und Phthalazin.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Die Synthese von Cinnolin gelingt über die Elektrolyse von (2-Nitrophenethyl)propylamin. Die Reaktion wird hierbei in einem gepufferten Gemisch aus Methanol und Wasser umgesetzt und liefert Cinnolin in mäßiger Ausbeute:[4]

Cinnolin-Derivate kann man auch mittels der Neber-Bössel-Synthese herstellen. Dabei wird z. B. 2-(2-Aminophenyl)-2-hydroxyessigsäure (1, R = H) zu 3-Hydroxylcinnolin (2, R = H) umgesetzt:[5]
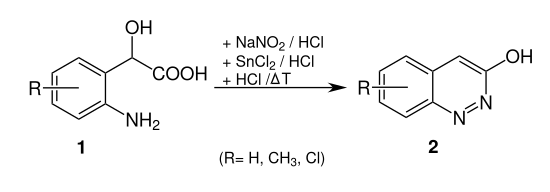
Die Borsche-Koelsch-Cinnolinsynthese ausgehend von ortho-Aminoarylketonen eröffnet einen weiteren Zugang zu Cinnolinen.[6]
Derivate
[Bearbeiten | Quelltext bearbeiten]Cinnolin ist die Ausgangsstruktur für viele Derivate.[7]
- Cinnolin-Hydrochlorid C8H6N2·HCl, CAS-Nummer: 5949-24-6
- Cinnolin-4-carbonsäure C9H6N2O2, CAS-Nummer: 21905-86-2
- 4(1H)-Cinnolinon C8H6N2O, CAS-Nummer: 18514-84-6
- Benzo[c]cinnolin C12H8N2, CAS-Nummer: 34524-78-2
- Cinoxacin (ein Antibiotikum)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ M. Busch, A. Rast: Ueber das Cinnolin., Chem. Ber., 1897, 30, S. 521–527 (doi:10.1002/cber.189703001103).
- ↑ a b J. S. Morley: Cinnolines. Part XX VII. The Preparation and Nitration of Cinnoline., J. Chem. Soc., 1951, S. 1971–1975.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ B. A. Frontana-Uribe, C. Moinet, L. Toupet, Eur. J. Org. Chem. 1999, 2, 419–430.
- ↑ Zerong Wang: Comprehensive Organic Name Reactions and Reagents, Volume 2. John Wiley, Hoboken (N.J.) 2009, ISBN 978-0-470-28662-3, S. 2022–2024.
- ↑ Zerong Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Hoboken, New Jersey 2010, ISBN 978-0-470-63885-9, Borsche-Koelsch Cinnoline Synthesis, S. 474–477, doi:10.1002/9780470638859.conrr104.
- ↑ Cinnolin-Derivate bei Chemicalland21.