Cryptochrome
Cryptochrome (von griechisch κρυπτός, kryptós, „verborgen“ und χρωμα, chróma, „Farbe“) sind 50 bis 70 kDa schwere Flavoproteine, die als Fotorezeptoren für blaues Licht fungieren können. Obwohl schon über hundert Jahre bekannt ist, dass Pflanzen auf Blaulicht reagieren, wurde erstmals 1993 durch die Isolierung einer cDNA das Cryptochrom in Pflanzen identifiziert und seitdem auch in Tieren gefunden.[1] Die Vorstufen dieser Proteine in Bakterien codieren für Licht-aktivierte Enzyme, die an der DNA-Reparatur beteiligt sind, eine Funktion, die in Eukaryonten nicht erhalten ist.[2] Cryptochrome enthalten zwei nicht kovalent gebundene Chromophore, das Flavin-Adenin-Dinukleotid (FAD) und einen lichtsammelnden Kofaktor.[3] Sie spielen eine Rolle bei der Aufrechterhaltung der circadianen Rhythmik bei Tieren und Pflanzen und bei der Magnetorezeption – der Wahrnehmung des Erdmagnetfeldes bei Tieren.[4]
Beschreibung und Funktion
[Bearbeiten | Quelltext bearbeiten]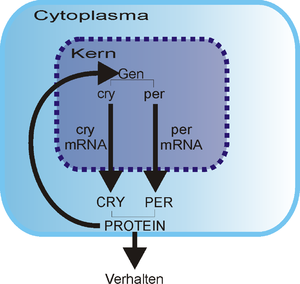

Cryptochrome sind insofern bemerkenswert, als dass sie in vitro nach Lichtabsorption ein Flavosemichinonradikal bilden können, das Licht nicht nur im Blaubereich des Spektrums absorbiert, sondern auch im Grün-, Gelb und Rotbereich.
Durch die Entdeckung des CRY-Gens bei Taufliegen, das den Pflanzengenen cry1 und cry2 sehr ähnlich ist und welches für die Produktion des CRY-Proteins verantwortlich ist, wurde die Hypothese, dass Cryptochrome bei der zirkadianen Organisation involviert sind, immer wahrscheinlicher.[5]
Untersuchungen an Knockout-Tieren zeigten, dass eine Maus Cryptochrome benötigt, um ein normales Funktionieren der zirkadianen Uhr zu gewährleisten.[6] Durch homologe Rekombination konnten Van der Horst et al. (1999) mutierte Mäuse generieren, die das Gen cry1, cry2 oder beide Gene nicht mehr besaßen. Die Mutanten verhielten sich unter 12 Stunden Licht und 12 Stunden Dunkelheit (LD 12:12) wie normale Mäuse, das heißt, sie waren in ihren Lebensäußerungen rhythmisch. Allerdings zeigten sie unter konstanten Bedingungen (24 Stunden Dunkelheit – DD) arrhythmisches Verhalten. Daraus konnte man schließen, dass die Cryptochrome anscheinend für eine normale Uhrfunktion essentiell waren. Es ist noch nicht bekannt, wie Cryptochrome mit anderen bekannten Maus-Uhr-Molekülen wie Clock, Periode oder Timeless interagiert oder wie die molekulare Basis der Uhr bei diesen mutanten Mäusen beeinflusst wird. CRY1 und CRY2 sind bei mutanten Mäusen sowohl in den Augen als auch im Nucleus suprachiasmaticus (SCN), dem Sitz der master-clock, gefunden worden. Daher könnte man annehmen, dass Cryptochrome bei Säugetieren für die Lichtdetektion verantwortlich sind. Allerdings sprechen die bis jetzt bekannten Fakten gegen eine Beteiligung der Cryptochrome bei der Lichtdetektion und zumindest für die Anwesenheit einer anderen Gruppe von Photopigmenten, den Opsinen.
Bei Zugvögeln konnten Wissenschaftler der Universität Oldenburg ebenfalls CRY1- und CRY2-Proteine in der Netzhaut nachweisen (Gartengrasmücke).[7] Hier konzentrieren sich die Proteine in speziellen Zelltypen der Retina, die besonders bei nachtziehenden Zugvögeln eine Rolle spielen; dann also, wenn sich die Gartengrasmücke vor allem magnetisch orientiert. Die Ergebnisse der Oldenburger Gruppe stützen die Hypothese, dass das Cryptochrom das magneto-sensorische Molekül sein könnte, das die magnetische Information in visuelle Signale übersetzt und es dem Vogel daher ermöglicht, mit Hilfe ihres Magnetsinns das Erdmagnetfeld der Erde wahrzunehmen. 2021 wurde ein entsprechender Quanteneffekt beschrieben.[8]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Aziz Sancar: Cryptochrome: The Second Photoactive Pigment in The Eye and Its Role in Circadian Photoreception. In: Annual Review of Biochemistry. Bd. 69, 2000, S. 31–67, doi:10.1146/annurev.biochem.69.1.31, PMID 10966452.
- Íbrahim Halil Kavaklı, Aziz Sancar: Circadian Photoreception in Humans and Mice. In: Molecular Interventions. Bd. 2, Nr. 8, 2002, S. 484–492, doi:10.1124/mi.2.8.484, PMID 14993400.
- Russell N. Van Gelder: Tales from the Crypt(ochromes). In: Journal of Biological Rhythms. Bd. 17, Nr. 2, 2002, S. 110–120, doi:10.1177/074873002129002401, PMID 12002158.
- Chentao Lin, Dror Shalitin: Cryptochrome Structure and Signal Transduction. In: Annual Review of Plant Biology. Bd. 54, 2003, S. 469–496, doi:10.1146/annurev.arplant.54.110901.160901, PMID 14503000.
- Qing-Hua Li, Hong-Quan Yang: Cryptochrome Signaling in Plants. In: Photochemistry and Photobiology. Bd. 83, Nr. 1, 2007, S. 94–101, doi:10.1562/2006-02-28-IR-826, PMID 17002522.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ M. Ahmad, A. R. Cashmore: HY4 gene of A. thaliana encodes a protein with characteristics of a blue-light photoreceptor. In: Nature. Band 366, Nummer 6451, November 1993, S. 162–166, doi:10.1038/366162a0, PMID 8232555.
- ↑ S. Weber: Light-driven enzymatic catalysis of DNA repair: a review of recent biophysical studies on photolyase. In: Biochimica et Biophysica Acta. Band 1707, Nummer 1, Februar 2005, S. 1–23, doi:10.1016/j.bbabio.2004.02.010, PMID 15721603 (Review).
- ↑ Christopher T. Rodgers, P. J. Hore: Chemical magnetoreception in birds: the radical pair mechanism. In: Proceedings of the National Academy of Sciences. Bd. 106, Nr. 2, 2009, S. 353–360, doi:10.1073/pnas.0711968106.
- ↑ A. Günther, A. Einwich, E. Sjulstok, R. Feederle, P. Bolte, K. W. Koch, I. A. Solov'yov, H. Mouritsen: Double-Cone Localization and Seasonal Expression Pattern Suggest a Role in Magnetoreception for European Robin Cryptochrome 4. In: Current biology : CB. Band 28, Nummer 2, Januar 2018, S. 211–223.e4, doi:10.1016/j.cub.2017.12.003, PMID 29307554.
- ↑ T. Todo, H. Ryo, K. Yamamoto, H. Toh, T. Inui, H. Ayaki, T. Nomura, M. Ikenaga: Similarity among the Drosophila (6-4)photolyase, a human photolyase homolog, and the DNA photolyase-blue-light photoreceptor family. In: Science. Band 272, Nummer 5258, April 1996, S. 109–112, PMID 8600518.
- ↑ G. T. van der Horst, M. Muijtjens, K. Kobayashi, R. Takano, S. Kanno, M. Takao, J. de Wit, A. Verkerk, A. P. Eker, D. van Leenen, R. Buijs, D. Bootsma, J. H. Hoeijmakers, A. Yasui: Mammalian Cry1 and Cry2 are essential for maintenance of circadian rhythms. In: Nature. Band 398, Nummer 6728, April 1999, S. 627–630, doi:10.1038/19323, PMID 10217146.
- ↑ H. Mouritsen, U. Janssen-Bienhold, M. Liedvogel, G. Feenders, J. Stalleicken, P. Dirks, R. Weiler: Cryptochromes and neuronal-activity markers colocalize in the retina of migratory birds during magnetic orientation. In: Proceedings of the National Academy of Sciences. Band 101, Nummer 39, September 2004, S. 14294–14299, doi:10.1073/pnas.0405968101, PMID 15381765, PMC 521149 (freier Volltext).
- ↑ Noboru Ikeya, Jonathan R. Woodward: Cellular autofluorescence is magnetic field sensitive. In: Proceedings of the National Academy of Sciences. Band 118, Nr. 3, 19. Januar 2021, ISSN 0027-8424, doi:10.1073/pnas.2018043118, PMID 33397812 (Online [abgerufen am 19. Juni 2021]). Dazu:
- Mike McRae: Birds Have a Mysterious 'Quantum Sense'. For The First Time, Scientists Saw It in Action, auf: sciencealert vom 8. Januar 2021 (englisch) [abgerufen am 12. Januar 2021]
- Lars Fischer: Quantensensor der Vögel erstmals direkt beobachtet, auf: spektrum.de vom 11. Januar 2021 (deutsch) [abgerufen am 12. Januar 2021 – Cryptochrome ist als Cryprochrome verschrieben]