Longifolen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Longifolen | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C15H24 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 204,36 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||
| Dichte |
0,9328 g·cm−3[3] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,504 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Longifolen ist der Trivialname eines natürlich vorkommenden Kohlenwasserstoffs. Longifolen ist ein chirales, rechtsdrehendes, tricyclisches Sesquiterpen.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Der Name leitet sich ab von Pinus longifolia, einem mittlerweile nicht mehr gebräuchlichen Name der Kiefer Pinus roxburghii, aus dessen Harz er isoliert wurde und in dem es in einer Konzentration von 5 bis 10 % vorliegt.[7][8][9]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Longifolen wird in der Organischen Chemie für die Herstellung von Dilongifolylboran, einem chiralen Hydroborierungsreagenz, verwendet.[10]
Longifolen ist einer der Hauptaromakomponenten der Teespezialität Lapsang Souchong, da diese über Kiefernholz geräuchert wird.[11]
Synthese
[Bearbeiten | Quelltext bearbeiten]Die Struktur der tricyclischen Verbindung wurde von verschiedenen Arbeitsgruppen untersucht. Die Totalsynthese von E. J. Corey führte dabei zur Entwicklung neuer synthetischer Methoden.[12]
Die Synthese nach Corey erfolgt ausgehend vom Wieland-Miescher-Keton in einer dreizehnstufigen Synthese über Wittig-Reaktion, Oxidation der dabei entstehenden Doppelbindung zum Diol mittels Osmiumtetroxid, Ringerweiterung,[13] interner Cyclisierung und weiterer Reaktionsschritte unter Bildung des Racemats.
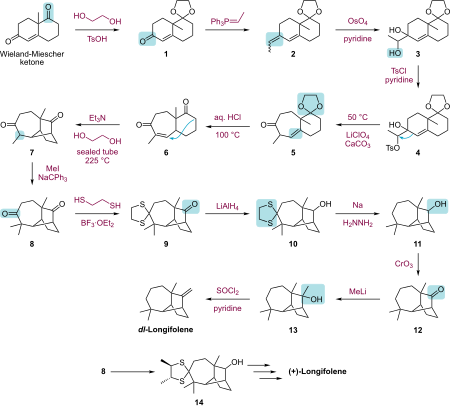
Die Darstellung der optisch aktiven Komponente gelingt in einer mehrstufigen Synthese mittels (+)-2,3-Butandithiol als chiralem Agent.[12]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu LONGIFOLENE in der CosIng-Datenbank der EU-Kommission, abgerufen am 30. Dezember 2021.
- ↑ a b c Datenblatt (+)-Longifolene bei Sigma-Aldrich, abgerufen am 28. Dezember 2013 (PDF).
- ↑ N. Mirov: Composition of Gum Turpentines of Pines, 1961, US Forest Service, Technical Bulletin No. 1239, US DEPT OF AGRICULTURE, S. 57.
- ↑ N. Mirov: Composition of Gum Turpentines of Pines, 1961, US Forest Service, Technical Bulletin No. 1239, US DEPT OF AGRICULTURE, S. 18.
- ↑ Europäisches Arzneibuch 10.0. Deutscher Apotheker Verlag, 2020, ISBN 978-3-7692-7515-5, S. 843.
- ↑ a b Eintrag zu (+)-Longifolen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ John Lionel Simonsen: LXI. The constituents of Indian turpentine from Pinus longifolia, Roxb. Part I. In: Journal of the Chemical Society, Transactions. 117, 1920, S. 570, doi:10.1039/CT9201700570.
- ↑ P. Naffa, G. Ourisson: Le Longifolene. 3. Addition des Hydracides Halogenes sur le Longifolene –Les Halogenures de Longibornyle-Produits Disomerisation du Longifolene. In: Bulletin de la Societe Chimique de France, 21.11-1 (1954), S. 1410–1415.
- ↑ Suhk Dev: The chemistry of longifolene and its derivatives. In: Fortschritte der Chemie organischer Naturstoffe/Progress in the Chemistry of Organic Natural Products, 1981, Springer Verlag, Wien, ISBN 978-3-7091-8613-8, S. 49–104.
- ↑ Prabhakar K. Jadhav, Herbert C. Brown: Dilongifolylborane: a new effective chiral hydroborating agent with intermediate steric requirements. In: The Journal of Organic Chemistry. 46, 1981, S. 2988–2990, doi:10.1021/jo00327a036.
- ↑ Shan-Shan Yao, Wen-Fei Guo, Y. i. Lu, Yuan-Xun Jiang: Flavor Characteristics of Lapsang Souchong and Smoked Lapsang Souchong, a Special Chinese Black Tea with Pine Smoking Process. In: Journal of Agricultural and Food Chemistry. 53, 2005, S. 8688–8693, doi:10.1021/jf058059i.
- ↑ a b E. J. Corey, Masaji. Ohno, Rajat B. Mitra, Paul A. Vatakencherry: Total Synthesis of Longifolene. In: Journal of the American Chemical Society. 86, 1964, S. 478–485, doi:10.1021/ja01057a039.
- ↑ Eric J. Kantorowski, Mark J. Kurth: Expansion to Seven-Membered Rings. In: Tetrahedron. 56. Jahrgang, Nr. 26, 1. Juni 2000, S. 4317–4353, doi:10.1016/S0040-4020(00)00218-0.

