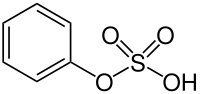
Phenylsulfat
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Phenylsulfat | |||||||||
| Summenformel | C6H6O4S | |||||||||
| Kurzbeschreibung |
weißer Feststoff (Kaliumsalz)[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 174,18 g·mol−1 (protoniert) | |||||||||
| Aggregatzustand |
fest (Kaliumsalz)[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
löslich in Wasser (Kaliumsalz)[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Phenylsulfat (auch Monophenylsulfat) ist der Monoester der Schwefelsäure mit Phenol. Er tritt einerseits in protonierter Form auf, andererseits als Salz, beispielsweise als Kaliumphenylsulfat.
Geschichte[Bearbeiten | Quelltext bearbeiten]

Die Bildung von Phenylsulfat im menschlichen und tierischen Metabolismus wurde im 19. Jahrhundert von Eugen Baumann entdeckt. 1876 berichtete er von einer neuen Verbindung, die er aus Urin isoliert hatte. Nachdem er zunächst irrtümlich angenommen hatte, dass es sich um eine Sulfonsäure handele, identifizierte er sie kurz darauf korrekt als das Kaliumsalz des Phenylsulfats. Später wies er nach, dass das Phenylsulfat sowohl bei Menschen als auch bei Hunden aus aufgenommenem Phenol entsteht. Außerderdem erforschte er die Toxizität der Verbindung und erkannte, dass die Bildung des Sulfats der Entgiftung dient, da es wesentlich weniger giftig ist als Phenol selbst. Die Sulfatierung ist eine wichtige Form der Konjugatbildung, die auch noch bei anderen Verbindungen auftritt, beispielsweise bei Brenzcatechin und Indol. Phenol war jedoch die erste Verbindung, bei der der Mechanismus nachgewiesen wurde.[2]
Herstellung[Bearbeiten | Quelltext bearbeiten]
Phenylsulfat entsteht bei der Hydrolyse von Diphenylsulfat.[S 1] Die Reaktion ist bei geeigneten Bedingungen selektiv, da der erste Hydrolyseschritt zum Phenylsulfat deutlich leichter abläuft als der zweite.[3]
Biologische Bedeutung[Bearbeiten | Quelltext bearbeiten]
Die Sulfatierung und Glucuronidierung sind die wichtigsten Mechanismen der Konjugatbildung von phenolischen Verbindungen. Bei der Sulfatierung des Grundkörpers der Stoffklasse, Phenol, entsteht Phenylsulfat. Die Reaktion wird durch eine Sulfotransferase katalysiert, diese kommen insbesondere in der Leber vor. Als Quelle für die Sulfatgruppe dient Phosphoadenosinphosphosulfat (PAPS).[4] Phenylsulfat eignet sich als Indikator für eine Exposition gegenüber Phenol.[5]
Phenylsulfat eignet sich möglicherweise zudem als Biomarker für die Früherkennung einer diabetischen Nephropathie. Eine Hauptkomponentenanalyse und weitere statistische Untersuchungen am Metabolom diabetischer Ratten ergaben einen klaren Zusammenhang zwischen dem Gehalt an Phenylsulfat im Blut und dem Vorliegen einer Nierenschädigung.[6]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Eintrag zu KaliumPhenylSulfate, >98.0% bei TCI Europe, abgerufen am 29. März 2024.
- ↑ A Roy: Eugen Baumann and sulphate esters. In: Trends in Biochemical Sciences. Band 1, Nr. 10, Oktober 1976, S. N233–N234, doi:10.1016/0968-0004(76)90168-7.
- ↑ Organic chemistry of sulfur. Plenum Pr, New York, NY 1977, ISBN 978-0-306-30740-9, S. 658.
- ↑ Nandita Shangari, Tom S. Chan, Peter J. O'Brien: Sulfation and Glucuronidation of Phenols: Implications in Coenyzme Q Metabolism. In: Methods in Enzymology. Band 400. Elsevier, 2005, S. 342–359, doi:10.1016/s0076-6879(05)00020-0.
- ↑ Masana Ogata, Yoshio Yamasaki, Toshio Kawai: Significance of urinary phenyl sulfate and phenyl glucuronide as indices of exposure to phenol. In: International Archives of Occupational and Environmental Health. Band 58, Nr. 3, August 1986, S. 197–202, doi:10.1007/BF00432101.
- ↑ Koichi Kikuchi, Daisuke Saigusa, Yoshitomi Kanemitsu, Yotaro Matsumoto, Paxton Thanai, Naoto Suzuki, Koki Mise, Hiroaki Yamaguchi, Tomohiro Nakamura, Kei Asaji, Chikahisa Mukawa, Hiroki Tsukamoto, Toshihiro Sato, Yoshitsugu Oikawa, Tomoyuki Iwasaki, Yuji Oe, Tomoya Tsukimi, Noriko N. Fukuda, Hsin-Jung Ho, Fumika Nanto-Hara, Jiro Ogura, Ritsumi Saito, Shizuko Nagao, Yusuke Ohsaki, Satoshi Shimada, Takehiro Suzuki, Takafumi Toyohara, Eikan Mishima, Hisato Shima, Yasutoshi Akiyama, Yukako Akiyama, Mariko Ichijo, Tetsuro Matsuhashi, Akihiro Matsuo, Yoshiaki Ogata, Ching-Chin Yang, Chitose Suzuki, Matthew C. Breeggemann, Jurgen Heymann, Miho Shimizu, Susumu Ogawa, Nobuyuki Takahashi, Takashi Suzuki, Yuji Owada, Shigeo Kure, Nariyasu Mano, Tomoyoshi Soga, Takashi Wada, Jeffrey B. Kopp, Shinji Fukuda, Atsushi Hozawa, Masayuki Yamamoto, Sadayoshi Ito, Jun Wada, Yoshihisa Tomioka, Takaaki Abe: Gut microbiome-derived phenyl sulfate contributes to albuminuria in diabetic kidney disease. In: Nature Communications. Band 10, Nr. 1, 23. April 2019, doi:10.1038/s41467-019-09735-4.
